题目内容
1.下列水溶液中电离方程式,书写正确的是( )| A. | AlCl3═Al3++Cl3- | B. | NaHSO4═Na++H++SO42- | ||
| C. | Mg(NO3)2═Mg+2+2NO3- | D. | NaHCO3═Na++H++CO32- |
分析 强电解质完全电离,电离方程式用“═”,弱电解质不能完全电离,利用“?”,结合原子、电荷守恒分析,注意弱酸根离子不能拆分.
解答 解:A.为强电解质,电离方程式为AlCl3═Al3++3Cl-,故A错误;
B.为强电解质,电离方程式为NaHSO4═Na++H++SO42-,故B正确;
C.为强电解质,镁离子符号错误,电离方程式为Mg(NO3)2═Mg2++2NO3-,故C错误;
D.为强电解质,电离方程式为NaHCO3═Na++HCO3-,故D错误;
故选B.
点评 本题考查电离方程式的书写,为高频考点,把握电解质的判断、酸根离子的书写等为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列有机物属于烷烃的是.( )
| A. | CH2=CH2 | B. | CH3CH2CH2CH2CI | C. | 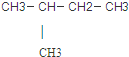 | D. | CH3CH2OH |
12.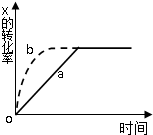 右图曲线a表示放热反应 2X(g)+Y(g)?2Z(g) 进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
右图曲线a表示放热反应 2X(g)+Y(g)?2Z(g) 进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
 右图曲线a表示放热反应 2X(g)+Y(g)?2Z(g) 进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
右图曲线a表示放热反应 2X(g)+Y(g)?2Z(g) 进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )| A. | 加催化剂 | B. | 加大X的投入量 | C. | 升高温度 | D. | 增大体积 |
9.298K时,0.5molN2(g)与适量H2(g)转化成NH3(g)放出46.1kJ的热量,则表示该反应的热化学方程式正确的是( )
| A. | N2(g)+3H2(g)═2NH3(g)△H(298K)=+92.2kJ•mol-1 | |
| B. | N2(g)+3H2(g)═2NH3(g)△H(298K)=-92.2kJ•mol-1 | |
| C. | N2(g)+3H2(g)═2NH3(g)△H(298K)=+46.1kJ•mol-1 | |
| D. | N2(g)+3H2(g)═2NH3(g)△H(298K)=-46.1kJ•mol-1 |
16.城市居民用的石油气主要成分是丁烷,在使用的过程中,常有一些杂质以液态沉积于钢瓶中,这种杂质是( )
| A. | 丙烷和丁烷 | B. | 乙烷和丙烷 | C. | 乙烷和戊烷 | D. | 戊烷和己烷 |
13.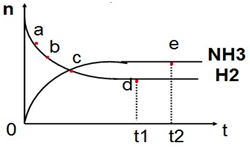 对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),△H<0在400℃2MPa下,n(NH3)和n(H2)随时间变化的关系如图所示,下列叙述正确的是( )
对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),△H<0在400℃2MPa下,n(NH3)和n(H2)随时间变化的关系如图所示,下列叙述正确的是( )
 对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),△H<0在400℃2MPa下,n(NH3)和n(H2)随时间变化的关系如图所示,下列叙述正确的是( )
对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),△H<0在400℃2MPa下,n(NH3)和n(H2)随时间变化的关系如图所示,下列叙述正确的是( )| A. | 点a的正反应速率比点b的小 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d和点e处n(N2)不一样 | |
| D. | 其他条件不变,500℃下反应至t1时刻,n(H2)比图中点d的值大 |
10.某固体物质只含有钠和氧两种元素,将它放在足量的水中产生两种气体,这两种气体又可以在一定条件下反应生成水.则原固体物质的组成是( )
| A. | Na2O2与Na2O | B. | Na和NaOH量 | C. | Na和Na2O | D. | Na2O2和Na |
11.用0.1mol/L的FeSO4溶液100mL,恰好将2×10-3mol的XO4-还原,则元素X在还原产物中的化合价是( )
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |