题目内容
铅蓄电池是典型的可充电电池,它的正负极隔板是惰性材料,电池总反应式为:Pb+PbO2+4H++2![]()
![]() 2PbSO4+2H2O,现有装置如下图,则下列说法正确的是
2PbSO4+2H2O,现有装置如下图,则下列说法正确的是
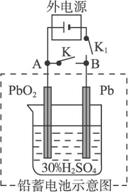
A.放电时负极反应是Pb-2e-====Pb2+,充电时阴极反应是PbSO4+2H2O-2e-====PbO2+4H+ +![]()
B.闭合K断开K1,电流的方向是从B到A
C.放电过程中,溶液的pH不断减小
D.放电时,线路上若有1 mol电子通过,则消耗硫酸也是1 mol
D
解析:本题考查原电池以及电解池的有关知识。解题时要明确这两个过程的相同点和不同点。放电时为原电池,负极材料为Pb,但是电解质溶液为H2SO4溶液,所以负极反应应生成PbSO4,而不是Pb2+,电子的流向为B到A,电流的方向应该与电子流动方向相反,所以A、B错误。由方程式可知,每转移2 mol e-则消耗4 mol H+,则转移1 mol e-消耗2 mol H+,即1 mol H2SO4,pH增大,得C错误。

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目
 铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO2-4
铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO2-4 铅蓄电池是典型的可充型电池,它的正负极是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-?2PbSO4+2H2O
铅蓄电池是典型的可充型电池,它的正负极是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-?2PbSO4+2H2O 铅蓄电池是典型的可充型电池,它的正负极极板是惰性材料,电池总反应式为:
铅蓄电池是典型的可充型电池,它的正负极极板是惰性材料,电池总反应式为: w.w.w.zxxk.c.o.m
w.w.w.zxxk.c.o.m 2PbSO4+2H2O
2PbSO4+2H2O