��Ŀ����
����Ŀ���ߴ�MnCO3���Ʊ������ܴ��Բ��ϵ���Ҫԭ�ϡ�ʵ������MnO2Ϊԭ���Ʊ������ߴ�MnCO3�IJ����������£�
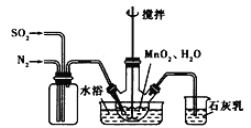
��1���Ʊ�MnSO4��Һ������ƿ����װ�ü���ͼ������һ����MnO2��ˮ�����裬ͨ��SO2��N2������壬��Ӧ3h��ֹͣͨ��SO2��������ӦƬ�̣����ˡ�
��д����Ӧ����ʽ��MnO2+ H2SO3=_________________��
ʯ������뷴Ӧ�Ļ�ѧ����ʽΪ___________________��
�ڷ�Ӧ�����У�ΪʹSO2������ת����ȫ����ͨ��SO2��N2����һ�������ı��ҺͶ�ϵ������£��ɲ�ȡ�ĺ�����ʩ������������________________��___________________��

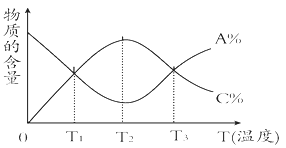
����ʵ���н�N2���ɿ�������÷�ӦҺ��Mn2+��SO42-��Ũ���淴Ӧʱ��t�仯����ͼ��������Һ��Mn2+��SO42-��Ũ�ȱ仯�������Բ���������Mn2+��O2��H2SO3��Ӧ�����������_________________��
��2���Ʊ��ߴ�MnCO3���壺��֪MnCO3������ˮ���Ҵ�����ʪʱ�ױ�����������100�濪ʼ�ֽ⣻Mn��OH��2��ʼ������pH= 7��7��
�벹������1���Ƶõ�MnSO4��Һ�Ʊ��ߴ�MnCO3�IJ�������[ʵ���п�ѡ�õ��Լ���H2O ��Ca��OH��2��NaHCO3��Na2CO3��C2H5OH]��
���߽������_________________����������ҺpH_______7��7��
��_______________________��
��_______________________��
��_______________________��
�ݵ���100����
���𰸡���1����MnO2��H2SO3��MnSO4��H2O SO2��Ca��OH��2��CaSO3��H2O���ڿ����ʵ����¶� ������ͨ�������壻��Mn2�� �������������ᷴӦ�������ᡣ��2����̼���ƻ�̼�����ơ������ڹ��ˣ�������ˮϴ��2-3�� �ۼ���SO42���Ƿ�ȥ �����������Ҵ�ϴ��
��������
�����������1���ٶ������̺������ᷢ��������ԭ��Ӧ���������̺�ˮ����ѧ����ʽΪMnO2+ H2SO3= MnSO4��H2O ��ʯ��������������ն���Ķ��������߷�Ӧ����������ƺ�ˮ����ѧ����ʽΪSO2��Ca��OH��2��CaSO3��H2O ���� ��Ӧ�����У�ΪʹSO2������ת����ȫ����ͨ��SO2��N2����һ�������ı��ҺͶ�ϵ������£��ɲ�ȡ�ĺ�����ʩ�п����ʵ����¶� ������ͨ�������塣�۵�����Һ��Mn2+��SO42-��Ũ�ȱ仯�������Բ��죬����Mn2+��O2��H2SO3��Ӧ�����������Mn2�� �������������ᷴӦ�������ᡣ
��2�����������Ϣ��MnCO3������ˮ���Ҵ�����ʪʱ�ױ�����������100�濪ʼ�ֽ⣻Mn��OH��2��ʼ������pH= 7��7��ʵ���п�ѡ�õ��Լ���H2O ��Ca��OH��2��NaHCO3��Na2CO3��C2H5OHȷ����MnSO4��Һ�Ʊ��ߴ�MnCO3�IJ�������Ϊ�ٱ߽������̼���ƻ�̼����������������ҺpHС��7��7�������ˣ�������ˮϴ��2-3����������SO42���Ƿ�ȥ�������������Ҵ�ϴ�����ݵ���100����

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�