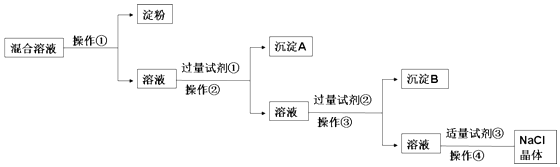
题目内容
【题目】与OH﹣具有相同质子数和电子数的粒子是( )
A.F﹣
B.Cl﹣
C.NH3
D.NH4+
【答案】A
【解析】解:A、F﹣的质子数为9,电子数为9+1=10,与OH﹣具有相同质子数和电子数,故A正确;
B、Cl﹣的质子数为17,电子数为17+1=18,故B错误;
C、NH3的质子数=电子数=7+1×3=10,故C错误;
D、NH4+的质子数为7+4=11,电子数为7+4﹣1=10,故D错误;
故选A.

练习册系列答案
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目