题目内容
[化学-化学与技术]硫酸工业生产应考虑综合经济效益问题.
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在______的郊区(填标号);
A.有丰富黄铁矿资源的城市
B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市
D.人口稠密的文化、商业中心城市
(2)CuFeS2是黄铁矿的另一成分,煅烧时CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为______.
(3)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是______.
A.黄铁矿燃烧前需要粉碎,因为大块的黄铁矿不能在空气中燃烧
B.从沸腾炉出来的炉气需净化,因为炉气中二氧化硫会与杂质反应
C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率
D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率
(4)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
已知CuSO4在低于660℃时不会分解,请简要分析上表中CuSO4的质量分数随温度升高而降低的原因______.
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在______的郊区(填标号);
A.有丰富黄铁矿资源的城市
B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市
D.人口稠密的文化、商业中心城市
(2)CuFeS2是黄铁矿的另一成分,煅烧时CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为______.
(3)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是______.
A.黄铁矿燃烧前需要粉碎,因为大块的黄铁矿不能在空气中燃烧
B.从沸腾炉出来的炉气需净化,因为炉气中二氧化硫会与杂质反应
C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率
D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率
(4)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
(1)A.硫酸厂厂址的选择综合经济效益考虑,硫酸产品的运输成本要高于原料黄铁矿的运输成本.故A不正确;
B.风光秀丽的旅游城市,不靠近原料基地,也不靠近消耗硫酸的工业城市,导致原料运输与产品运输成本高,同时还会对旅游城市造成污染.故B不正确;
C.由于硫酸产品的运输成本要高于原料黄铁矿的运输成本,所以厂址应选择在消耗硫酸甚多的工业城市.故C正确;
D.人口稠密的文化、商业中心城市,远离原料基地和消耗硫酸的工业城市,同时为了防止污染环境,不宜考虑作为硫酸厂厂址.故D不正确;
故答案为:C;
(2)根据题意可知,高温煅烧时CuFeS2时,反应物为CuFeS2和O2,生成物为CuO、Fe2O3和SO2,再根据化合价升降法配平氧化还原反应方程式,
故答案为:4CuFeS2+13O2
4CuO+2Fe2O3+8SO2;
(3)A.在硫酸工业制法中,黄铁矿燃烧前需要粉碎,是为了增大与空气的接触面,加快反应速率,不是因为大块的黄铁矿不能在空气中燃烧.故A不正确;
B.从沸腾炉出来的炉气中含有SO2、O2、N2、水蒸气、灰尘、砷硒化合物等,由于砷硒化合物能导致催化剂失去催化活性,因此需净化,不是因为炉气中二氧化硫会与杂质反应,故B不正确;
C.二氧化硫氧化为三氧化硫时需使用催化剂,目的是加快反应速率,提高产量.并不能提高二氧化硫的转化率,故C不正确;
D.在吸收塔中三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率.故D正确;
故答案为:D;
(4)硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在沸腾炉中化合而成),根据题意由表中数据可知,硫酸铜的质量分数随沸腾炉温度升高而降低,是因为反应CuO+SO3
CuSO4中SO3的质量减少导致的,根据2SO2(g)+O2(g)
2SO3(g)),△H=-98.3kJ?mol-1反应制备SO3,该反应为可逆反应,正方向为放热,随着温度升高,平衡逆向移动,导致SO3的量减少,由CuO与SO3在沸腾炉中化合而成CuSO4的量也减少.
故答案为:SO2转化为SO3是正反应放热的可逆反应,随温度升高,平衡左移,SO3物质的量减少,所以CuSO4的量减少(或温度升高,SO3物质的量减少,故CuSO4的量减少).
B.风光秀丽的旅游城市,不靠近原料基地,也不靠近消耗硫酸的工业城市,导致原料运输与产品运输成本高,同时还会对旅游城市造成污染.故B不正确;
C.由于硫酸产品的运输成本要高于原料黄铁矿的运输成本,所以厂址应选择在消耗硫酸甚多的工业城市.故C正确;
D.人口稠密的文化、商业中心城市,远离原料基地和消耗硫酸的工业城市,同时为了防止污染环境,不宜考虑作为硫酸厂厂址.故D不正确;
故答案为:C;
(2)根据题意可知,高温煅烧时CuFeS2时,反应物为CuFeS2和O2,生成物为CuO、Fe2O3和SO2,再根据化合价升降法配平氧化还原反应方程式,
故答案为:4CuFeS2+13O2
| ||
(3)A.在硫酸工业制法中,黄铁矿燃烧前需要粉碎,是为了增大与空气的接触面,加快反应速率,不是因为大块的黄铁矿不能在空气中燃烧.故A不正确;
B.从沸腾炉出来的炉气中含有SO2、O2、N2、水蒸气、灰尘、砷硒化合物等,由于砷硒化合物能导致催化剂失去催化活性,因此需净化,不是因为炉气中二氧化硫会与杂质反应,故B不正确;
C.二氧化硫氧化为三氧化硫时需使用催化剂,目的是加快反应速率,提高产量.并不能提高二氧化硫的转化率,故C不正确;
D.在吸收塔中三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率.故D正确;
故答案为:D;
(4)硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在沸腾炉中化合而成),根据题意由表中数据可知,硫酸铜的质量分数随沸腾炉温度升高而降低,是因为反应CuO+SO3
| ||
| 催化剂 |
| △ |
故答案为:SO2转化为SO3是正反应放热的可逆反应,随温度升高,平衡左移,SO3物质的量减少,所以CuSO4的量减少(或温度升高,SO3物质的量减少,故CuSO4的量减少).

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目

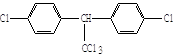
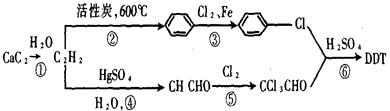
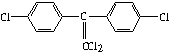
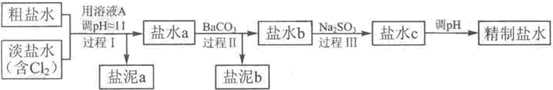
 化钠,可实现潜艇舱内的空气交换
化钠,可实现潜艇舱内的空气交换