题目内容
北京时间2013年12月2日凌晨1时30分,我国的“嫦娥三号”月球探测器在西昌卫星发射中心发射升空,发射“嫦娥三号”月球探测器的火箭推进器中装有还原剂肼(N2H4)和氧化剂N2O4,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热。已知0.4 mol气态肼和足量N2O4气体反应生成氮气和水蒸气时放出219.3 kJ的热量。
(1)写出肼和N2O4反应的热化学方程式: ;
(2)已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1,则16 g气态肼与足量N2O4气体反应生成氮气和液态水时,放出的热量是 ;
(3)肼除应用于火箭燃料外,还可作为燃料电池的燃料,由肼和空气构成的碱性燃料电池的负极反应式为: ,正极反应式为: ;
(4)向次氯酸钠溶液中通入一定物质的量的氨气可生成肼,写出反应的离子方程式: 。
(1)2N2H4(g)+N2O4(g) = 3N2(g)+4H2O(g) ΔH=-1096.5kJ·mol-1(热化学方程式和反应热各1分)
(2)318.1 kJ(未写单位不得分)
(3)N2H4-4e-+4OH- = N2+4H2O O2+4e-+2H2O = 4OH-
(4)2NH3+ClO-= N2H4+Cl-+H2O
解析试题分析:(1)已知0.4 mol气态肼和足量N2O4气体反应生成氮气和水蒸气时放出219.3 kJ的热量。则2mol液态肼放出的热量为219.3 kJ×5=1096.5 kJ
所以反应的热化学方程式为:2N2H4(g)+N2O4(g) = 3N2(g)+4H2O(g) ΔH=-1096.5kJ·mol-1
(2)已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1
所以有反应的热化学方程式为:2N2H4(g)+N2O4(g) = 3N2(g)+4H2O(l) ΔH=-1272.5kJ·mol-1
16 g气态肼的物质的量="16g/32g/mol=0.5mol," 放出的热量Q=1272.5 kJ /4="318.1" kJ
(3)由肼和空气构成的碱性燃料电池的负极反应式为:N2H4-4e-+4OH- = N2+4H2O 正极反应式为:O2+4e-+2H2O = 4OH-
(4)向次氯酸钠溶液中通入一定物质的量的氨气可生成肼, 次氯酸钠是氧化剂,被还原为氯化钠,氨气做还原剂,被氧化为肼。2NH3+ClO-= N2H4+Cl-+H2O
考点:热化学方程式的书写,电极反应式的书写。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案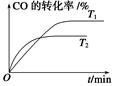

 CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。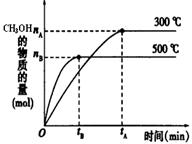


 O2(g)=CO2(g) ΔH2=b kJ·mol-1
O2(g)=CO2(g) ΔH2=b kJ·mol-1 2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为P0,反应过程中压强用P表示,反应过程中
2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为P0,反应过程中压强用P表示,反应过程中 与时间t的关系如图所示。
与时间t的关系如图所示。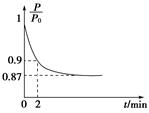


 ,△H=__________kJ
,△H=__________kJ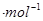 (用含a、b、c、d的式子表示)。
(用含a、b、c、d的式子表示)。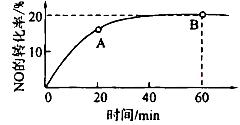
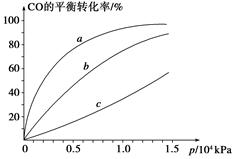
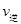 (CO)___________B点的逆反应速率
(CO)___________B点的逆反应速率
 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。

 N2O4(g) ΔH2=-56.9 kJ·mol-1
N2O4(g) ΔH2=-56.9 kJ·mol-1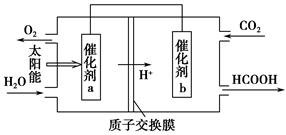
 [Cu(NH3)3]Ac?CO(aq)(△H<0)
[Cu(NH3)3]Ac?CO(aq)(△H<0)