题目内容
10.下列叙述正确的是( )| A. | 浓硫酸可以干燥C12,也能干燥SO2 | |
| B. | SO2具有漂白性,能使碘的淀粉溶液由蓝色变为无色 | |
| C. | 光纤主要成分是SiO2,具有导电性 | |
| D. | 使用漂白液时,为了增强漂白效果,可以向漂白液中加入浓盐酸 |
分析 A.浓硫酸具有吸水性,与氯气、二氧化硫都不反应;
B.依据二氧化硫的还原性解答;
C.二氧化硅为绝缘体;
D.次氯酸根离子与氯离子发生氧化还原反应生成氯气.
解答 解:A.浓硫酸具有吸水性,与氯气、二氧化硫都不反应,所以可以干燥氯气、二氧化硫,故A正确;
B.能使碘的淀粉溶液由蓝色变为无色,体现二氧化硫的还原性,故B错误;
C.二氧化硅为绝缘体,不导电,故C错误;
D.使用漂白液时,漂白与酸反应生成具有漂白性的次氯酸,则增强漂白能力,应加入酸,但次氯酸与浓盐酸反应生成氯气,故D错误;
故选:A.
点评 本题考查了元素化合物知识,熟悉浓硫酸、二氧化硫、次氯酸钙性质是解题关键,题目难度不大.

练习册系列答案
相关题目
20.A、B、C、D、E是短周期的五种元素,原子序数依次增大,有关信息如下表所示.
填写下列空白.
(1)C元素为N.
(2)由上述两种元素组成的含有非极性键的一种化合物的化学式为H2O2等.
(3)A、B、C、D四种元素原子个数为7:2:1:2的离子化合物的化学式为CH3COONH4.
(4)由上述两种元素组成含有30个电子的阴离子,其钠盐水溶液呈碱性,理由是AlO2-+2H2O?Al(OH)3+OH-(用离子方程式表示).
| 元素 | 部分结构和性质 |
| A | 所有元素中原子半径最小 |
| B | 次外层电子数为最外层电子数的一半 |
| C | 单质由双原子分子构成,分子中有14个电子 |
| D | 地壳中含量最高的元素 |
| E | 最高价氧化物对应的水化物能溶于强酸和强碱 |
(1)C元素为N.
(2)由上述两种元素组成的含有非极性键的一种化合物的化学式为H2O2等.
(3)A、B、C、D四种元素原子个数为7:2:1:2的离子化合物的化学式为CH3COONH4.
(4)由上述两种元素组成含有30个电子的阴离子,其钠盐水溶液呈碱性,理由是AlO2-+2H2O?Al(OH)3+OH-(用离子方程式表示).
1.下列有关电解池的叙述不合理的是( )
| A. | 高温电解熔融氯化钠时,阴极得金属钠、阳极得氯气 | |
| B. | 工业电解饱和食盐水时,阴极区生成烧碱溶液和氢气、阳极得氯气 | |
| C. | 实验室用碳棒作电极电解氯化铜溶液时,在阴、阳极分别得到氯气和铜 | |
| D. | 镀锌时将两极材料浸入含锌离子的电解液中,锌棒接电源正极,待镀件接电源负极 |
18.下列变化属于不加成反应的是( )
| A. | 乙烯通入酸性高锰酸钾溶液 | B. | 乙烯通入溴水中 | ||
| C. | 乙烯在一定条件下与氢气反应 | D. | 乙烯与氯化氢在一定条件下反应 |
5.化学与生活、生产密切相关,下列说法正确的是( )
| A. | 制作宇航员航天服的聚酯纤维不属于新型无机非金属材料 | |
| B. | 煤的主要成分为单质碳、苯、二甲苯等,可通过煤的干馏将它们分离 | |
| C. | PM2.5是指粒径在2.5微米以下的颗粒物,其在空气中形成的分散系属于胶体 | |
| D. | 为防止中秋月饼等富脂食品氧化变质,常在包装中放入生石灰 |
19.由H2S03和H3PO3组成的混合酸82g,测知其中含氧元素58.54%,则混酸中H2S03和H3PO3的物质的量之比为( )
| A. | 只能是1:1 | B. | 只能是3:1 | C. | 只能是4:1 | D. | 任意比 |
20.短周期主族元素X、Y、Z、W、Q的原子序数依次增大.X原子最外层电子数是次外层的2倍;Y的氟化物YF3分子中各原子均达到8电子稳定结构;Z、W是常见金属,Z是同周期中原子半径最大的元素,同周期元素的简单离子中W离子半径最小,X和Z原子序数之和与Q相等.下列说法正确的是( )
| A. | 最高价氧化物对应水化物的酸性:Q>Y>X | |
| B. | 简单气态氢化物的稳定性:X>Y>Q | |
| C. | X与Q形成的化合物为离子化合物 | |
| D. | 等质量的Z和W单质分别与足量稀盐酸反应时,前者获得的氢气多 |
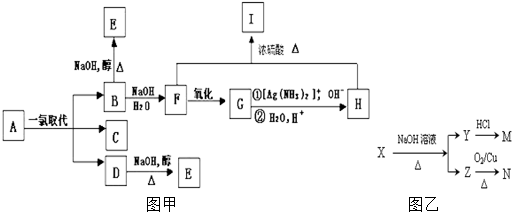

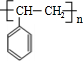
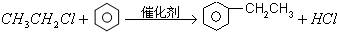 ,⑥
,⑥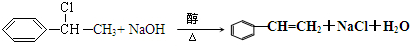 .
.