题目内容
【题目】实验室制备1,2-二溴乙烷的反应原理如下:

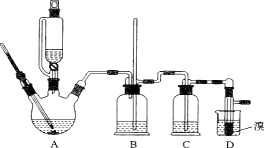
用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -1l6 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是 ;
a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体;
a.水 b.浓硫酸
c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是 ;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”、“下”);
(5)若产物中有少量副产物乙醚.可用 的方法除去;
若产物中有少量未反应的Br2,最好用 洗涤除去;
a.水 b.氢氧化钠溶液
c.碘化钠溶液 d.乙醇
(6)下列关于装置的说法正确的是 ;
a.A的滴液漏斗的侧面导管有利于液体顺利滴落
b.B的长导管可防止反应出现堵塞情况
c.B有防倒吸作用
(7)反应过程中应用冷水冷却装置D,其主要目的是 ;但又不能过度冷却(如用冰水),其原因是 。
【答案】
(1)d;(2)c;
(3)溴的颜色完全褪去;
(4)下;(5)蒸馏,b ;(6)abc;
(7)避免溴大量挥发;产品1,2-二溴乙烷的凝固点低,过度冷却会凝固而堵塞导管。
【解析】
试题分析:(1)乙醇在浓硫酸140℃的条件下,发生分子内脱水,生成乙醚,故答案为:d;
(2)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应,故答案为:c;
(3)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色,故答案为:溴的颜色完全褪去;
(4)1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大,故答案为:下;
(5)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离;常温下Br2和氢氧化钠发生反应:2NaOH+Br2═NaBr+NaBrO+H2O,故答案为:蒸馏;b;
(6)a.A的滴液漏斗的侧面导管使滴液漏斗液面上方的压强与装置内压强相等,有利于液体顺利滴落,正确;b.如果反应出现堵塞,B的长导管中的液面将上升,正确;c.如果出现倒吸,外界空气可以从B进入装置,从而防倒吸,正确;故选abc;
(7)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却,故答案为:乙烯与溴反应时放热,冷却可避免溴的大量挥发;1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞。