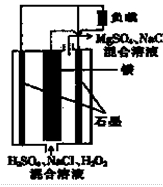
题目内容
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是( )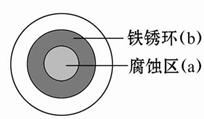
| A.液滴中的Cl-由a区向b区迁移 |
| B.液滴边缘是正极区,发生的电极反应为O2+2H2O+4e-=4OH- |
| C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈 |
| D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为Cu-2e-=Cu2+ |
B
解析

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
如图所示a、b 都是惰性电极,通电—段时间后,a极附近溶液显红色。下列说法中正确的是( )。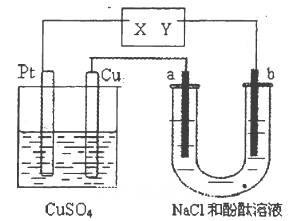
| A.X是正极,Y是负极 | B.X是负极,Y是正极 |
| C.CuSO4溶液的浓度逐渐减小 | D.CuSO4溶液的pH减小 |
下列叙述正确的是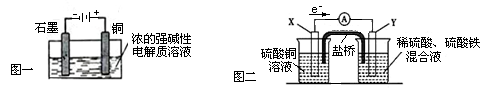
| A.Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图一所示,石墨电极上产生氢气,铜电极发生氧化反应 |
| B.图一所示当有0.1mol电子转移时,有0.1molCu2O生成 |
| C.图二装置中发生:Cu+2Fe3+ = Cu2++2Fe2+,X极是负极,Y极材料可以是铜 |
| D.如图二,盐桥的作用是传递电荷以维持电荷平衡,Fe3+经过盐桥进入左侧烧杯中 |
某化学兴趣小组的同学用如图所示装置研究电化学问题。当闭合该装置的电键时,观察到电流计的指针发生偏转。下列有关说法错误的是
| A.甲装置是原电池,乙装置是电解池 |
| B.当甲中产生0.1 mol气体时,乙中析出固体的质量为6.4 g |
| C.实验一段时间后,甲烧杯中溶液的pH增大 |
| D.将乙中的C电极换成铜电极,则乙装置可变成电镀装置 |
银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去。下列说法正确的是( )
| A.处理过程中银器一直保持恒重 |
| B.银器为正极,Ag2S被还原生成单质银 |
| C.该过程中总反应为2Al+3Ag2S=6Ag+Al2S3 |
| D.黑色褪去的原因是黑色Ag2S转化为白色AgCl |
如图所示是探究铁发生腐蚀的装置图。发现开始时U形管左端红墨水水柱下降,一段时间后U形管左端红墨水水柱又上升。下列说法中不正确的是( )
| A.开始时发生的是析氢腐蚀 |
| B.一段时间后发生的是吸氧腐蚀 |
| C.两种腐蚀负极的电极反应式均为Fe-2e-=Fe2+ |
| D.析氢腐蚀的总反应式为2Fe+O2+2H2O=2Fe(OH)2 |
下列关于电化学知识说法正确的是( )
| A.电解AlCl3、FeCl3、CuCl2的混合溶液,在阴极上依次析出Cu、Fe、Al |
| B.电解CuSO4溶液一段时间后,加入适量Cu(OH)2可以使溶液恢复至原状态 |
| C.铅蓄电池在充电时,连接电源正极发生的电极反应为PbSO4+2e-=Pb+SO42- |
| D.将钢闸门与直流电流的负极相连,可防止钢闸门腐蚀 |
下列说法正确的是 ( )。
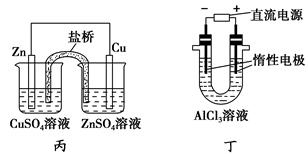
| A.用甲装置电解精炼镁 |
| B.用乙装置验证试管中铁丝发生析氢腐蚀 |
| C.用丙装置构成铜锌原电池 |
| D.用丁装置利用电冶金法制铝 |