题目内容
【题目】用NH3催化还原氮的氧化物,可以消除氮的氧化物的污染。已知:
反应①:4NH3(g)+ 6NO(g)![]() 5N2(g) + 6H2O(l) △H1
5N2(g) + 6H2O(l) △H1
反应②:2NO(g) + O2(g)![]() 2NO2(g) △H2(△H2<0且
2NO2(g) △H2(△H2<0且![]() )
)
反应③:4NH3(g) + 6NO2(g)![]() 5N2(g)+ 3O2 + 6H2O(l) △H3
5N2(g)+ 3O2 + 6H2O(l) △H3
反应①和反应②在不同温度时的平衡常数及其大小关心如下表:
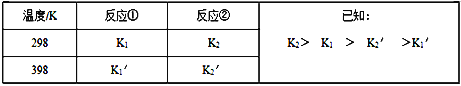
(1)试推测反应③是______ 反应(填“吸热”或“放热”)
(2)相同条件下反应①在2L的密闭容器中选用不同的催化剂,反应产生N2的物质的量随时间的变化如图所示。
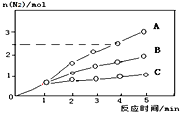
则:
①计算0~4min时在A催化剂作用下,反应速率v(NO)=__________。
②下列说法正确的是:__________________。
A.该反应的活化能大小顺序是:Ea(A)>Ea(B) >Ea(C)
B.增大压强能使反应速率加快的原因,是因为增加活化分子的百分数
C.单位时间内H-O键与N-H断裂的数目相等时,说明反应已达平衡状态
D.若在恒容绝热的密闭容器中进行,当温度不变时,说明反应已达平衡状态
(3)对于反应②,若在某温度下,在容积为2L的刚性密闭容器中起始加入2 molNO和2 molO2,反应一段时间后,测的生成NO21.6mol,则该反应是否达到平衡状态?_______(填“是”或“不是”。已知该温度下该反应的K约为147.3)。达平衡后,在同一温度下向大小相同的另一刚性容器中加入1.2mol的NO2和0.9mol的O2,则还要加入NO______mol、O2_____mol,达平衡时各物质的浓度才能跟前平衡的相等。
【答案】 吸热 v(NO)=0.375mol/L CD 不是 0.8mol 0.5mol
【解析】(1)根据表中数据可知升高温度反应①、②的平衡常数均减小,这说明二者均是放热反应。根据盖斯定律可知①-②×3即得到反应③的△H3=△H1-3△H2,由于△H2<0且![]() ),所以△H3=△H1-3△H2>0,因此反应③是吸热反应;(2)①0~4min时在A催化剂作用下此时生成氮气是2.5mol,所以消耗NO是2.5mol×6/5=3.0mol,浓度是1.5mol/L,反应速率v(NO)=1.5mol/L÷4min=0.375mol/L。②A.曲线斜率越大,反应速率越大,活化能越小,则该反应的活化能大小顺序是:Ea(A)<Ea(B) <Ea(C),A错误;B.增大压强能使反应速率加快的原因,是因为增加了单位体积内活化分子的百分数,活化分子的百分数不变,B错误;C.根据方程式可知单位时间内H-O键与N-H断裂的数目相等时,说明正逆反应速率相等,反应已达平衡状态,C正确;D.若在恒容绝热的密闭容器中进行,当温度不变时,说明正逆反应速率相等,反应已达平衡状态,D正确,答案选CD;(3)对于反应②,若在某温度下,在容积为2L的刚性密闭容器中起始加入2 molNO和2 molO2,反应一段时间后,测的生成NO21.6mol,则根据方程式可知消耗NO和氧气分别是1.6mol、0.8mol,剩余NO和氧气分别是0.4mol、1.2mol,此时NO、氧气、二氧化氮的浓度分别是(mol/L)0.2、0.6、0.8,浓度熵为
),所以△H3=△H1-3△H2>0,因此反应③是吸热反应;(2)①0~4min时在A催化剂作用下此时生成氮气是2.5mol,所以消耗NO是2.5mol×6/5=3.0mol,浓度是1.5mol/L,反应速率v(NO)=1.5mol/L÷4min=0.375mol/L。②A.曲线斜率越大,反应速率越大,活化能越小,则该反应的活化能大小顺序是:Ea(A)<Ea(B) <Ea(C),A错误;B.增大压强能使反应速率加快的原因,是因为增加了单位体积内活化分子的百分数,活化分子的百分数不变,B错误;C.根据方程式可知单位时间内H-O键与N-H断裂的数目相等时,说明正逆反应速率相等,反应已达平衡状态,C正确;D.若在恒容绝热的密闭容器中进行,当温度不变时,说明正逆反应速率相等,反应已达平衡状态,D正确,答案选CD;(3)对于反应②,若在某温度下,在容积为2L的刚性密闭容器中起始加入2 molNO和2 molO2,反应一段时间后,测的生成NO21.6mol,则根据方程式可知消耗NO和氧气分别是1.6mol、0.8mol,剩余NO和氧气分别是0.4mol、1.2mol,此时NO、氧气、二氧化氮的浓度分别是(mol/L)0.2、0.6、0.8,浓度熵为![]() ,所以该反应没有达到平衡状态。达平衡后,在同一温度下向大小相同的另一刚性容器中加入1.2mol的NO2和0.9mol的O2,则相当于是1.2molNO和1.5mol氧气,所以根据等效平衡可知还要加入NO为2mol-1.2mol=0.8mol、O2为2mol-1.5mol=0.5mol,达平衡时各物质的浓度才能跟前平衡的相等。
,所以该反应没有达到平衡状态。达平衡后,在同一温度下向大小相同的另一刚性容器中加入1.2mol的NO2和0.9mol的O2,则相当于是1.2molNO和1.5mol氧气,所以根据等效平衡可知还要加入NO为2mol-1.2mol=0.8mol、O2为2mol-1.5mol=0.5mol,达平衡时各物质的浓度才能跟前平衡的相等。