题目内容
【题目】合成氨工业上常用下列方法制备H2:
方法①:C(s)+2H2O(g)![]() CO2(g)+2H2(g)
CO2(g)+2H2(g)
方法②:CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
(1)已知①C(石墨)+O2(g)═CO2(g)△H=-394kJmol-1
②2C(石墨)+O2(g)═2CO2(g)△H=-222kJmol-1
③2H2(g)+O2(g)═2H2O(g)△H=-484kJmol-1
试计算25℃时由方法②制备1000gH2所放出的能量为______kJ。
(2)在一定的条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器,发生反应:C(s)+2H2O(g)![]() CO2(g)+2H2(g)其相关数据如下表所示:
CO2(g)+2H2(g)其相关数据如下表所示:

①T1______T2(填“>”、“=”或“<”);T1℃时,该反应的平衡常数K=______。
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度范围是______。
③在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是______。
A.V逆CO2)=2V正H2)
B.混合气体的密度保持不变
C.c(H2O):c(CO2):c(H2)=2:1:2
D.混合气体的平均摩尔质量保持不变
④某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示:

在t1、t3、t5、t7时反应都达了到平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则t6时刻改变的条件是________________________,从t1到t8哪个时间段H2O(g)的平衡转化率最低______。
【答案】(1)20500kJ;(2)①>;12.8;② 大于0.8mol/L,小于1.4mol/L ;③BD;④ 通入H2O;t7-t8
【解析】
试题分析:(1)CO(g)+H2O(g)![]() CO2(g)+H2(g)的,△H=△H1-△H2-△H3= -394kJmol-1-(-111kJmol-1)- (-242kJmol-1)=-41kJmol-1,所以制备1000g H2所放出的能量为20500kJ,故答案为:20500;
CO2(g)+H2(g)的,△H=△H1-△H2-△H3= -394kJmol-1-(-111kJmol-1)- (-242kJmol-1)=-41kJmol-1,所以制备1000g H2所放出的能量为20500kJ,故答案为:20500;
(2)①如果两者温度相等,甲相对乙,甲平衡时H2(g)平衡量为2.4mol,而是3.2,说明温度改变平衡正向移动,而正反应为吸热反应,所以T1>T2;
由表中数据可知,平衡时氢气的物质的量为3.2mol,则:
C(s)+2H2O(g)![]() CO2(g)+2H2(g)
CO2(g)+2H2(g)
开始(mol): 2 4 0 0
转化(mol): 1.6 3.2 1.6 3.2
平衡(mol): 0.4 0.8 1.6 3.2
平衡常数K=![]() =
=![]() =12.8,故答案为:>;12.8;
=12.8,故答案为:>;12.8;
②3min内水蒸气的浓度变化量=氢气的浓度变化量的=![]() =1.2mol/L,随反应进行,物质的浓度降低,反应速率变小,故前1.5min水的浓度变化量大于后1.5min水的浓度变化量,故反应进行到1.5min时,H2O(g)的物质的量浓度小于2mol/L-1.2mol/L×
=1.2mol/L,随反应进行,物质的浓度降低,反应速率变小,故前1.5min水的浓度变化量大于后1.5min水的浓度变化量,故反应进行到1.5min时,H2O(g)的物质的量浓度小于2mol/L-1.2mol/L×![]() =1.4mol/L,大于2mol/L-1.2mol/L=0.8 mol/L,故答案为:0.8 mol/L<c(H2O)<1.4mol/L;
=1.4mol/L,大于2mol/L-1.2mol/L=0.8 mol/L,故答案为:0.8 mol/L<c(H2O)<1.4mol/L;
③A.V逆(CO2)=![]() V逆(H2)=2V正(H2),正逆速度不等,故不选;B混合气体的密度保持不变,说明气体质量不变,正逆速度相等,故选;C.c(H2O):c(CO2):c(H2)=2:1:2,而不是不变,故不选;D.混合气体的平均相对分子质量未平衡时在变,现在保持不变,说明已达平衡状态,故选;故选BD;
V逆(H2)=2V正(H2),正逆速度不等,故不选;B混合气体的密度保持不变,说明气体质量不变,正逆速度相等,故选;C.c(H2O):c(CO2):c(H2)=2:1:2,而不是不变,故不选;D.混合气体的平均相对分子质量未平衡时在变,现在保持不变,说明已达平衡状态,故选;故选BD;
④t1到t6平衡都逆向移动,而t6时平衡正向移动,是因为增加反应物的浓度,而C是固体,所以是增加水蒸气的量,所以本身的转化率降低,t8时反应速率增大,但平衡不移动,故平衡转化率最低t7-t8 (或“t7到t8”),t4时刻速率都比原来速率小,平衡逆向,所以是降低温度,故答案为:通入H2O;t7-t8。

【题目】下表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准)。
烯类化合物 | 相对速率 |
(CH3)2C=CHCH3 | 10.4 |
CH3CH=CH2 | 2.03 |
CH2=CH2 | 1.00 |
CH2=CHBr | 0.04 |
(1)下列化合物与氯化氢加成时,取代基对速率的影响与表中规律类似,其中反应速率最快的是______(填序号)。
A.(CH3)2C=C(CH3)2 B.CH3CH=CHCH2CH3
C.CH2=CH CH3 D.CH2=CHCl
(2)烯烃与溴化氢、水加成时,产物有主次之分,例如:
CH2=CHCH3+HBr→CH3CHBrCH3+CH3CH2Br
(主要产物)(次要产物)
请写出 与HBr反应的主要产物的结构简式_____________。
与HBr反应的主要产物的结构简式_____________。
【题目】随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%,二氧化碳(CO2)的排放量也要大幅减少。
(1)在恒温,容积为1 L恒容中,硫可以发生如下转化,其反应过程和能量关系如图1所示(已知:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:

①写出能表示硫的燃烧热的热化学方程式:_________________________________。
②ΔH2=__________kJ·mol-1。
③在相同条件下,充入1 mol SO3和0.5 mol的O2,则达到平衡时SO3的转化率为______________;此时该反应________(填“放出”或“吸收”)________kJ的能量。
(2)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
①CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。
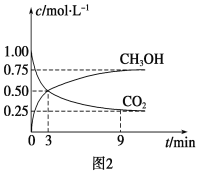
②能说明上述反应达到平衡状态的是________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
③为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有________(填编号)。
A.升高温度 B.缩小容器体积 C.再充入CO2气体 D.使用合适的催化剂
(3)工业上,CH3OH也可由CO和H2合成。参考合成反应CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数。下列说法正确的是________。
CH3OH(g)的平衡常数。下列说法正确的是________。
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应ΔS<0
C.在T ℃时,1 L密闭容器中,投入0.1 mol CO和0.2 mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5 MPa)和250 ℃,是因为此条件下,原料气转化率最高


