题目内容
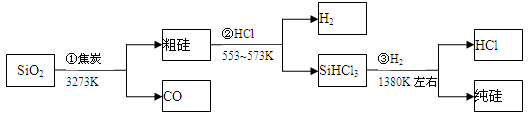
单晶硅是制作电子集成电路的基础材料。科学家预计,到2014年一个电脑芯片上将会集成100亿个晶体管,其功能远比我们想象的要大的多,这对硅的纯度要求很高。用化学方法可制得高纯度硅,其化学方程式为 :
①SiO2 + 2C Si + 2CO
Si + 2CO
②Si + 2Cl2 SiCl4
SiCl4
③SiCl4 + 2H2 Si + 4HCl
Si + 4HCl
其中,反应①和③属于
①SiO2 + 2C
 Si + 2CO
Si + 2CO②Si + 2Cl2
 SiCl4
SiCl4③SiCl4 + 2H2
 Si + 4HCl
Si + 4HCl其中,反应①和③属于
| A.化合反应 | B.分解反应 | C.置换反应 | D.复分解反应o |
C
试题分析:置换反应是单质与化合物反应产生新的单质和新的化合物的反应。这两个反应都属于置换反应。

练习册系列答案
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目
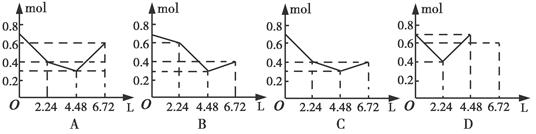
 CH3OH(g)△H1=-116 kJ·mol-1
CH3OH(g)△H1=-116 kJ·mol-1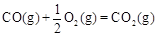 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1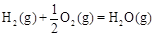 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
 CH3OH(g)的平衡常数K= 。
CH3OH(g)的平衡常数K= 。  CaSiO3+CO↑
CaSiO3+CO↑