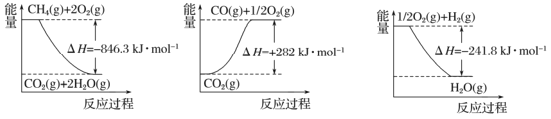
题目内容
【题目】肼(N2H4)的性质类似于氨气,易溶于水,是塑料、橡胶发泡剂的原料。将肼蒸汽通入CuO胶体中,可发生如图所示的转化
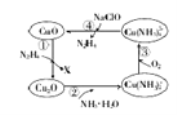
(1)图示的转化中,属于非氧化还原反应的是_________(填序号)。
(2)转化①中,氧化剂与还原剂的物质的量之比为4:1,则X的化学式为______。
(3)转化②中,反应一段时间后,溶液中n(OH—)_________(填“增大”“减小”或“不变”)
(4)加入NaClO时发生的反应为Cu(NH3)42++2ClO—+2OH—=Cu(OH)2↓+2N2H4↑+2Cl—+2H2O。该反应需在80℃以上进行,其目的除加快反应速率外,还有_______、__________。
(5)若①中参加反应的CuO物质的量为0.4mol,按图示转化过程进行后,④中生成的CuO物质的量也等于0.4mol,则③中参加反应的O2的物质的量与④中参加反应的NaClO的物质的量之比为______。
【答案】(1)②(1分)
(2)N2(2分)
(3)增大(2分)
(4)使氢氧化铜分解;降低肼的溶解度,促使其从溶液中逸出(各1分)
(5)1:8(2分)。
【解析】
试题分析:(1)非氧化还原反应即无元素化合价变化的反应,反应②中铜元素、氮元素和氢元素以及氧元素的化合价均没有变化,故为非氧化还原反应,其它反应中都有元素化合价的变化,都属于氧化还原反应,故图示的转化中,属于非氧化还原反应的是②;(2)在反应①中,N2H4做还原剂,CuO做氧化剂,则X为氧化产物,设X中氮元素为a价,则根据氧化剂与还原剂的物质的量之比为4:1有:4×(2-1)=1×2×(a-2+2),可解得a=0,即X为氮气,X的化学式为:N2;(3)转化②中的离子方程式为:Cu2O+4NH3H2O= 2Cu(NH3)2++ 2OH-+3H2O,故溶液中氢氧根的物质的量增大;(4)加入NaClO时发生的反应为Cu(NH3)42++2ClO—+2OH—=Cu(OH)2↓+2N2H4↑+2Cl—+2H2O。该反应需在80℃以上进行,其目的除加快反应速率外,还有就是溶液的温度高时氢氧化铜分解,且N2H4气体溶解度随温度升高而降低,从溶液中逸出,从而促进反应向正反应方向进行;(5)在整个转化过程中满足铜元素的守恒,故若①中参加反应的CuO物质的量为0.4mol,按图示转化过程进行后,Cu(NH3)2+的物质的量是0.4mol,发生反应③后Cu(NH3)2+被O2氧化产生Cu(NH3)42+,根据电子守恒可知反应消耗O2的物质的量是(0.4mol×1)÷4=0.1mol;根据反应④Cu(NH3)42++2ClO—+2OH—=Cu(OH)2↓+2N2H4↑+2Cl—+2H2O可知0.4mol Cu(NH3)42+反应消耗NaClO的物质的量是0.4mol×2=0.8mol,所以③中参加反应的O2的物质的量与④中参加反应的NaClO的物质的量之比为0.1mol:0.8mol=1:8。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】下列关于物质分类的正确组合是( )
类别 组合 | 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 |
A | CO2 | SiO2 | H2SO4 | KOH | NaHCO3 |
B | CO | Na2O | HCl | NaOH | NaCl |
C | SO2 | CuO | CH3COOH | Na2CO3 | CaF2 |
D | SO3 | CaO | HNO3 | Ca(OH)2 | CaCO3 |
A. A B. B C. C D. D