题目内容
Cl2合成有机物时会产生副产物HC1。4HCl+O2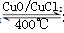 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。
完成下列填空:
(1)该反应平衡常数的表达式K= ;若反应容器的容积为2L,8min后达到平衡,测得容器内物质由2.5mol减少至2.25mol,则HCl的平均反应速率为 mol/L? min。
(2)若该反应在体积不变的密闭容器中发生,当反应达平衡时,下列叙述正确的是 。
a.v (HCl)="2" v(Cl2)
b.4v正(HCl)= v逆(O2)
c.又加入1mol O2,达新平衡时,HCl的转化率增大
d.分离出H2O,达新平衡时,v正(HCl)增大
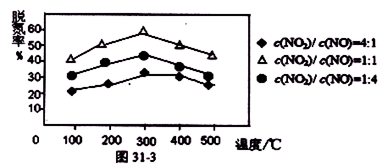
(3)下图是该反应两种投料比[n (HCl):n (O2)分别为4:1和2:1 ] 下,反应温度对HCl平衡转化率影响的曲线。下列叙述正确的是 。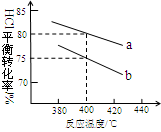
a.该反应的正反应是放热反应
b.其他条件不变,升高温度,平衡常数K值增大
c.若平衡常数K值变大,达新平衡前v逆始终减小
d.若平衡常数K值变大,则平衡向正反应方向移动
(4)投料比为4:1、温度为400℃时,平衡混合物中Cl2的物质的量分数是 。
(1)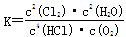 (1分) 0.0625mol/L?min (1分)
(1分) 0.0625mol/L?min (1分)
(2)a c(2分)
(3)a d(2分)
(4)0.3529(0.353、0.35均可)(2分)
解析试题分析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据方程式4HCl+O2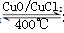 2Cl2+2H2O可知,该反应的平衡常数
2Cl2+2H2O可知,该反应的平衡常数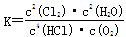 ;8min后达到平衡,测得容器内物质由2.5mol减少至2.25mol,则:
;8min后达到平衡,测得容器内物质由2.5mol减少至2.25mol,则:
4HCl+O2 2Cl2+2H2O 物质的量减少△n
2Cl2+2H2O 物质的量减少△n
4mol 1mol
n(HCl) 2.5mol-2.25mol=0.25mol
所以n(HCl)=0.25mol×4=1mol
则c(HCl)=1mol÷2L=0.5mol/L
故v(HCl)=0.5mol/L÷8min=0.0625mol/(L?min)
(2)a.平衡时不同物质表示的速率之比等于化学计量数之比,故v(HCl)=2v(Cl2),因此a正确;b.4v正(HCl)=v逆(O2),即4v正(HCl): v逆(O2)=1:4,不等于化学计量数之比4:1,反应未到达平衡,向逆反应进行,故b错误;c.加入1mol O2,氧气的浓度增大,平衡向正反应方向移动,HCl的转化率增大,故c正确; d.分离出H2O,生成的浓度降低,达新平衡时,v正(HCl)降低,故d错误,答案选ac。
(3)a.由图可知,投料比一定时,温度越高HCl的转化率越低,故该反应正反应是放热反应,因此a正确;b.升高温度平衡向逆反应方向移动,平衡常数k降低,故b错误;c.平衡常数增大应降低温度,平衡向正反应方向移动,改变体积瞬间反应速率降低,此后正反应速率降低、逆反应速率增大,故c错误;d.平衡常数增大应降低温度,该反应正反应是放热反应,平衡向正反应方向移动,故d正确,答案选ad。
(4)增大一种反应物的浓度,平衡向正反应方向移动,其它反应物的转化率增大,故投料比n(HCl):n(O2)=2:1到达平衡时HCl的转化率更高。由图象可知,a曲线表示的HCl的转化率更高,故a表示投料比为2:1,b表示投料比为4:1。由图可知,投料比为4:1、温度为40℃时,HCl的转化率为75%,设n(HCl):=4mol、n(O2)=1mol,则参加反应的HCl为4mol×75%=3mol,则:
4HCl+O2 2Cl2+2H2O
2Cl2+2H2O
起始量(mol) 4 1 0 0
变化量(mol) 3 0.75 1.5 1.5
平衡量(mol) 1 0.25 1.5 1.5
所以平衡混合物中Cl2的物质的量分数是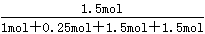 =0.3529。
=0.3529。
考点:考查反应速率、平衡常数的有关计算;外界条件对反应速率和平衡状态的影响

 53随堂测系列答案
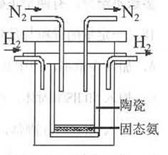
53随堂测系列答案某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数的测定。将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g) △H =" a" kJ/mol
2NH3(g)+CO2(g) △H =" a" kJ/mol
实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/mol·L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
①取一定量的氨基甲酸铵固体放在一个100L的密闭真空容器中,在25.0 ℃达到分解平衡。则反应 热(填“吸”或“放”) kJ/mol(用含a字母表示)。若将温度降到15.0 ℃,再次达平衡后氨基甲酸铵固体改变 g
②根据表中数据,列式计算25.0 ℃时的分解平衡常数: .
(8分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)。根据题意完成下列问题:
CH3OH(g)。根据题意完成下列问题: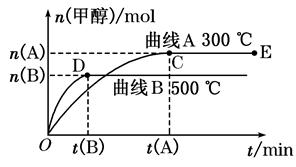
(1)反应达到平衡时,平衡常数表达式K=_________________,升高温度,K值___________(填“增大”、“减小”或“不变”),平衡向 方向移动。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=________________。
(3)在其他条件不变的情况下,将处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是________(选填选项字母)。
| A.氢气的浓度减少 |
| B.正反应速率加快,逆反应速率也加快 |
| C.甲醇的物质的量增加 |
D.重新平衡时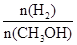 增大 增大 |
(1)固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。某科学实验将6molCO2和8molH2充入2L密闭容器中,测得H2的物质的量随时间变化如右图所示(实线)。图中数据a(1,6)代表的意思是:在l min时H2的物质的量是6mol。
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。某科学实验将6molCO2和8molH2充入2L密闭容器中,测得H2的物质的量随时间变化如右图所示(实线)。图中数据a(1,6)代表的意思是:在l min时H2的物质的量是6mol。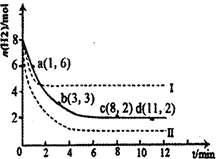
①下列时间段平均反应速率最大的是__________,最小的是______________。
| A.0~1min | B.1~3min | C.3~8min | D.8~11min |
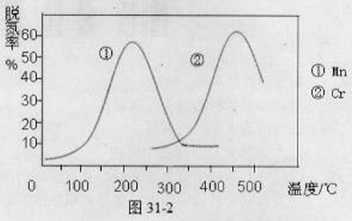
(2)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,等量的CO2和H2O(g)在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如图所示。在0~30 h内,CH4的平均生成速率v(Ⅰ)、v(Ⅱ)和v(Ⅲ)从大到小的顺序为 。反应开始后的12小时内,在第___________种催化剂的作用下,收集的CH4最多。

 4NH3 (g)+3O2 (g)+ Q
4NH3 (g)+3O2 (g)+ Q 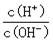
 W (s) + 3H2O (g) 请回答下列问题:
W (s) + 3H2O (g) 请回答下列问题: WI4 (g)。下列说法正确的有__________。
WI4 (g)。下列说法正确的有__________。 2NH3(g)+92.4 kJ/mol673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如右图所示。
2NH3(g)+92.4 kJ/mol673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如右图所示。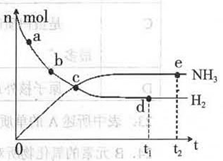
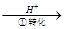 Cr2O72-
Cr2O72-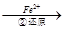 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓  Cr2O72- (橙色)+H2O
Cr2O72- (橙色)+H2O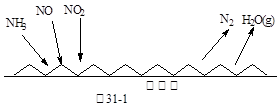
 H2SO3(l)
H2SO3(l)