题目内容
下列说法正确的是
| A.碘化铵和氯化铵受热分解过程中破坏和形成的化学键类型完全相同 |
| B.反应N2H4(l)=N2(g)+2H2(g)是一个△S>0的反应 |
| C.1 mol FeCl3完全水解得到的Fe(OH)3胶体中胶粒数目为NA(NA为阿伏加德罗常数) |
| D.HClO是弱酸,所以NaClO是弱电解质 |
B
解析试题分析:A.碘化铵受热分解产生氨气和HI,HI会发生分解反应产生H2、I2,该反应是可逆反应,而氯化铵受热分解只产生氨气和HCl,因此过程中破坏和形成的化学键类型不完全相同,错误;B.反应N2H4(l)=N2(g)+2H2(g)是一个体系混乱程度增大的反应,所以△S>0,正确;C.在溶液中盐水解的程度是微弱的,所以若1 mol FeCl3完全水解得到的Fe(OH)3就是沉淀,表示胶体,错误; D.HClO是弱酸,但是其产生的盐NaClO是强电解质,错误。
考点:考查物质的化学性质及反应特点的知识。

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
(13分)近现代战争中,制造坦克战车最常用的装甲材料是经过轧制和热处理后的合金钢,热处理后整个装甲结构的化学和机械特性和最大限度的保持一致。钢中合金元素的百分比含量为:铬0.5~1.25 镍0.5~1.5 钼0.3~0.6 锰0.8~1.6 碳0.3
(1)铬元素的基态原子的价电子层排布式是 。
(2)C元素与其同主族下一周期元素组成的晶体中,C原子的杂化方式为 .
(3)Mn和Fe的部分电离能数据如表:
| 元 素 | Mn | Fe | |
| 电离能 /kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
根据表数据,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。
(4)镍(Ni)可形成多种配合物,且各种配合物有广泛的用途。
某镍配合物结构如右图所示,分子内含有的作用力
有 (填序号)。
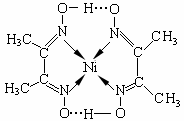
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
组成该配合物分子且同属第二周期元素的电负性由大到小的顺序是 。
(5)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测:四羰基镍的晶体类型是
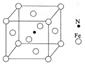
(6)铁能与氮形成一种磁性材料,其晶胞结构如右图所示,则该磁性材料的化学式为
已知BeCl2为共价化合物。 下列对于BeCl2分子的说法正确的是
| A.由极性键构成的极性分子 | B.由非极性键构成的非极性分子 |
| C.由非极性键构成的极性分子 | D.由极性键构成的非极性分子 |
下列表述不正确的是( )
| A.131I与127I互为同位素,化学性质几乎相同 |
| B.pm 2. 5含有铅、镉、铬、钒等对人体有害的金属元素 |
| C.除去SO2中混有的少量HCl,使气体通过盛有饱和NaHSO3溶液的洗气瓶 |
| D.为了证明氢氧化钠是离子化合物,可在瓷坩埚中将氢氧化钠固体熔化后测其导电性 |
以下大小关系不正确的是
| A.熔点:Na>Mg | B.硬度:金刚石>晶体硅 |
| C.键能:H—F>H—Cl | D.晶格能:NaF>NaCl |
下列叙述正确的是
| A.非金属原子间以共价键结合的物质一定是共价化合物 |
| B.含有共价键的化合物一定是共价化合物 |
| C.凡是能电离出离子的化合物一定是离子化合物 |
| D.凡是含有离子键的化合物一定是离子化合物 |
