题目内容
【题目】水合肼(N2H4·H2O)是无色、有强碱性和强还原性的液体,是一种重要的化工试剂,某新型生产工艺设计如下:
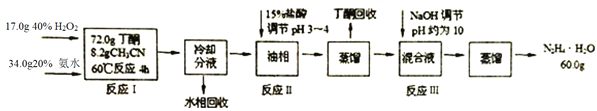
己知:①乙腈CH3CN:无色液体,与水任意比例互溶:丁酮![]() :无色液体,有毒,沸点79.6℃,密度0.81g· cm-3,在水中以1:4溶解;
:无色液体,有毒,沸点79.6℃,密度0.81g· cm-3,在水中以1:4溶解;
②反应 I 的化学方程式为:2NH3+ H2O2+![]()
![]()
![]() +4H2O
+4H2O
请回答:
(1)反应I中H2O2需逐滴滴加至混合溶液中,原因是______________________________;
(2)该新型生产工艺可将水相和丁酮回收循环使用,实现清洁化生产,水相的主要溶质成分是_____________________________;
(3)反应II加入盐酸操作的实验装置如图所示,虚线框内最为合适的仪器是_________,优点是___________。

(4)在加入足量盐酸后,肼以盐的形式存在请写出反应Ⅲ的化学方程式_________;
(5)称取水合肼馏分1.00g,加水配成2.0mL溶液,在一定条件下,用0.300mol/L的I2溶液滴定,来测定水合肼的产率。
已知:N2H4·H2O+2I2=N2↑+4HI+H2O。
①滴定时,可选用的指示剂为_________;
②实验测得消耗I2溶液的平均值为20.00mL,则N2H4·H2O的产率为_________。
【答案】 防止H2O2分解,且避免反应过于剧烈 乙腈、丁酮 C 防止盐酸(和丁酮)挥发污染环境;平衡气压,液体顺利流下 N2H4·2HCl + 2NaOH = N2H4 + 2NaCl +2H2O 淀粉溶液 90.0%
【解析】(1)如果一次性混合,反应非常剧烈,放热,可能导致H2O2分解,故分批加入。故答案为:防止H2O2分解,且避免反应过于剧烈;
(2)根据已知条件乙腈与水任意比例互溶,丁酮在水中以1:4溶解,故水相的主要溶质为乙腈和丁酮;
(3)最合适的仪器为C装置,C为恒压分液漏斗,可以平衡分液漏斗内外气压,便于液体顺利流下。故答案为:C;
(4)N2H4可写作H2N-NH2,故肼的性质可类比氨基酸中的-NH2,-NH2+ HCl→-NH2·HCl,-NH2·HCl+NaOH→-NH2+NaCl+ H2O。所以有N2H4+2HCl→N2H4·2HCl,再加NaOH,生成N2H4。故反应Ⅲ的方程式为N2H4·2HCl + 2NaOH = N2H4 + 2NaCl +2H2O;
(5)①碘的标准溶液与肼反应完全,再滴入碘的标准液后,遇淀粉变蓝色,实验滴定重点的现象为:溶液出现蓝色且半分钟内不消失,所以选择淀粉为指示剂;
故答案为:淀粉溶液;
(2)设1g馏分中水合肼的质量为a,则
N2H4·H2O + 2I2 =N2↑+4HI+H2O
50g 2mol
a 0.300mol/L×0.020L
所以![]() ,解得a=0.15g。
,解得a=0.15g。
题中一共收集到60.0g馏分,这其中N2H4·H2O的质量为:60.0g×![]() =9.0g。
=9.0g。
17.0g 40%H2O2,n(H2O2)= ![]() ,34.0g 20%氨水,n(NH3)=
,34.0g 20%氨水,n(NH3)= ![]() ,根据关系式2NH3~H2O2~1N2H4·H2O,可知N2H4·H2O的理论产量为0.2mol,质量为50g/mol×0.2mol=10.0g。
,根据关系式2NH3~H2O2~1N2H4·H2O,可知N2H4·H2O的理论产量为0.2mol,质量为50g/mol×0.2mol=10.0g。
所以,N2H4·H2O的产率为: ![]() 。
。
故答案为:90.0%

