题目内容
取Na2CO3、NaHCO3和NaCl的混合物100 g,加热到质量不再继续减少为止,剩下的残渣为84.5 g,取残渣8.45 g放入烧瓶中,缓缓加入20 g盐酸(过量)至气泡不再产生后称量,全部溶液净重25.15 g。试计算混合物中各组分的质量。
m(NaHCO3)="42" g;
m(Na2CO3)="7.95" g×10-26.5 g="53" g;
m(NaCl)="100" g-42 g-53 g="5" g。
m(Na2CO3)="7.95" g×10-26.5 g="53" g;
m(NaCl)="100" g-42 g-53 g="5" g。
因为NaCl、Na2CO3在加热时不分解也不挥发,所以质量减少是由于NaHCO3分解放出CO2和水蒸气所致,由此反应的质量差,可求出NaHCO3质量。残渣8.45 g与盐酸反应前后的质量差即为Na2CO3与HCl反应生成CO2的质量,据此可求出Na2CO3的质量(原有的和NaHCO3分解生成的总量的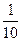 )。最后由混合物质量100 g,求出NaCl的质量。
)。最后由混合物质量100 g,求出NaCl的质量。
2NaHCO3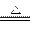 Na2CO3+H2O+CO2↑ Δm
Na2CO3+H2O+CO2↑ Δm
168 106 62
x y 100 g-84.5 g="15.5" g
解得x="42" g y="26.5" g
Na2CO3+2HCl====2NaCl+H2O+CO2↑ Δm
106 g 44
z 8.45 g+20 g-25.15 g="3.3" g
解得 z="7.95" g。
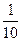 )。最后由混合物质量100 g,求出NaCl的质量。
)。最后由混合物质量100 g,求出NaCl的质量。2NaHCO3
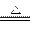 Na2CO3+H2O+CO2↑ Δm
Na2CO3+H2O+CO2↑ Δm168 106 62
x y 100 g-84.5 g="15.5" g
解得x="42" g y="26.5" g
Na2CO3+2HCl====2NaCl+H2O+CO2↑ Δm
106 g 44
z 8.45 g+20 g-25.15 g="3.3" g
解得 z="7.95" g。

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目