题目内容
【题目】下列反应属于氧化还原反应的是
A. NH3 + HCl =NH4Cl
B. 2NaHCO3 ![]() Na2CO3 + CO2↑ + H2O
Na2CO3 + CO2↑ + H2O
C. H2SO4+2NaOH = Na2SO4+2H2O
D. Cl2 + H2O = HCl + HClO
【答案】D
【解析】A. NH3 + HCl=NH4Cl反应中没有元素的化合价发生变化,不属于氧化还原反应,故A错误;B. 2NaHCO3 ![]() Na2CO3 + CO2↑ + H2O反应中没有元素的化合价发生变化,不属于氧化还原反应,故B错误;C. H2SO4+2NaOH=Na2SO4+2H2O反应中没有元素的化合价发生变化,不属于氧化还原反应,故C错误;D. Cl2+H2O=HCl+HClO反应中氯元素的化合价由0价变成-1价和+1价,属于氧化还原反应,故D正确;故选D。
Na2CO3 + CO2↑ + H2O反应中没有元素的化合价发生变化,不属于氧化还原反应,故B错误;C. H2SO4+2NaOH=Na2SO4+2H2O反应中没有元素的化合价发生变化,不属于氧化还原反应,故C错误;D. Cl2+H2O=HCl+HClO反应中氯元素的化合价由0价变成-1价和+1价,属于氧化还原反应,故D正确;故选D。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案【题目】I用CO2和氢气制备甲醇是解决能源危机的方向之一。
已知:2H2(g)+CO(g) CH3OH(g) △H1= -90.7kJ/mol
2CH3OH(g) CH3OCH3(g)+H2O(g) △H2= -23.5 kJ/mol
3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) △H3= -246.4 kJ/mol
(1)则CO2与氢气合成甲醇的热化学方程式为:____________________________________________,T℃时,将4molCO2与10mol H2通入1L密闭容器中,时间t与甲醇物质的量的关系见下表
时间t/h | 0 | 2 | 4 | 6 | 8 | 10 |
n(甲醇)/mol | 0 | 1.4 | 2.3 | 2.8 | 3.0 | 3.0 |
回答下列问题:
(2)欲提高氢气的平衡转化率,应采取的措施为____________________________(任意写两种)
(3)该温度下,反应的平衡常数K=________
II 采用如下装置电解亚硫酸钠亦可制备硫酸与氯碱工业的一种产物
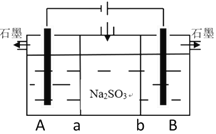
(4)A、B池中的电解质溶液应该是_____________、_____________,a为______离子交换膜。
(5)写出B池发生的电极反应式___________________________________________________
(6)Na2SO3溶液中离子浓度由大到小的排列顺序为__________________________________