题目内容
(2011?山东)[物质结构与性质]
氧是地壳中含量最多的元素
(1)氧元素基态原子核外未成对电子数为
(2)H2O分子内O-H键、分子间的范德华力和氢键从强到弱依次为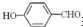 沸点比
沸点比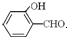 高,原因是
高,原因是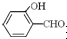 形成分子内氢键,而
形成分子内氢键,而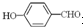 形成分子间氢键,分子间氢键使分子间作用力增大.
形成分子间氢键,分子间氢键使分子间作用力增大. 形成分子内氢键,而
形成分子内氢键,而 形成分子间氢键,分子间氢键使分子间作用力增大..
形成分子间氢键,分子间氢键使分子间作用力增大..
(3)H+可与H2O形成H3O+,H3O+中O原子采用
(4)CaO与NaCl的晶胞同为面心立方结构,已知CaO的密度为ag?cm-3,NA表示阿伏家的罗常数,则CaO晶胞的体积为
.
.
cm3.
氧是地壳中含量最多的元素
(1)氧元素基态原子核外未成对电子数为
2
2
个.(2)H2O分子内O-H键、分子间的范德华力和氢键从强到弱依次为
O-H键、氢键、范德华力
O-H键、氢键、范德华力
. 沸点比
沸点比 高,原因是
高,原因是 形成分子内氢键,而
形成分子内氢键,而 形成分子间氢键,分子间氢键使分子间作用力增大.
形成分子间氢键,分子间氢键使分子间作用力增大. 形成分子内氢键,而
形成分子内氢键,而 形成分子间氢键,分子间氢键使分子间作用力增大.
形成分子间氢键,分子间氢键使分子间作用力增大.(3)H+可与H2O形成H3O+,H3O+中O原子采用
sp3
sp3
杂化.H3O+中H-O-H键角比H2O中H-O-H键角大,原因是H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,排斥力较小
H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,排斥力较小
.(4)CaO与NaCl的晶胞同为面心立方结构,已知CaO的密度为ag?cm-3,NA表示阿伏家的罗常数,则CaO晶胞的体积为
| 224 |
| aNA |
| 224 |
| aNA |
cm3.
分析:(1)s能级有一个轨道,最多排2个电子,p能级有3个轨道,每个轨道最多排2个电子,结合洪特规则分析;
(2)化学键的键能大于氢键的键能,氢键的键能大于分子间作用力;氢键对物质的物理性质产生影响,分子间氢键使物质的沸点升高,分子内氢键使物质的沸点降低;
(3)先确定VSEPR模型,然后在确定中心原子的杂化轨道类型;一般来说,相互之间排斥力的大小为:孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力;
(4)先计算一个氧化钙分子的质量,再用均摊法求出一个晶胞含有的阴阳离子数,然后根据V=
求出其体积.
(2)化学键的键能大于氢键的键能,氢键的键能大于分子间作用力;氢键对物质的物理性质产生影响,分子间氢键使物质的沸点升高,分子内氢键使物质的沸点降低;
(3)先确定VSEPR模型,然后在确定中心原子的杂化轨道类型;一般来说,相互之间排斥力的大小为:孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力;
(4)先计算一个氧化钙分子的质量,再用均摊法求出一个晶胞含有的阴阳离子数,然后根据V=
| m |
| ρ |
解答:解:(1)氧元素基态原子核外电子排布式为1s22s22p4,4个电子在三个轨道中排布,故未成对电子数为2个,故答案为:2;
(2)共价键的键能大于氢键的作用力,氢键的作用力还大于范德华力,故H2O分子内的O-H键、分子间的范德华力和氢键从强到弱依次为O-H键、氢键、分子间的范德华力;含分子间氢键的物质的沸点大于分子内氢键物质的沸点,因此原因是前者易形成分子间氢键,后者易形成分子内氢键.
故答案为:O-H键、氢键、范德华力; 形成分子内氢键,而
形成分子内氢键,而 形成分子间氢键,分子间氢键使分子间作用力增大;
形成分子间氢键,分子间氢键使分子间作用力增大;
(3)H3O+价层电子对模型为四面体,氧原子采取sp3杂化.
H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,因为孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力,导致H3O+中H-O-H键角比H2O中H-O-H键角大.
故答案为:sp3;H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,排斥力较小
(4)1个“CaO”的质量为
=
g,而用均摊法算出一个晶胞含有4个“CaO”,即一个晶胞质量为
g×4=
g,又有ρ=
,则V=
,
V=
g÷ag/cm3=
cm3,则CaO晶胞体积为
cm3.
故答案为:
.
(2)共价键的键能大于氢键的作用力,氢键的作用力还大于范德华力,故H2O分子内的O-H键、分子间的范德华力和氢键从强到弱依次为O-H键、氢键、分子间的范德华力;含分子间氢键的物质的沸点大于分子内氢键物质的沸点,因此原因是前者易形成分子间氢键,后者易形成分子内氢键.
故答案为:O-H键、氢键、范德华力;
 形成分子内氢键,而
形成分子内氢键,而 形成分子间氢键,分子间氢键使分子间作用力增大;
形成分子间氢键,分子间氢键使分子间作用力增大;(3)H3O+价层电子对模型为四面体,氧原子采取sp3杂化.
H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,因为孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力,导致H3O+中H-O-H键角比H2O中H-O-H键角大.
故答案为:sp3;H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,排斥力较小
(4)1个“CaO”的质量为
| 56g/mol |
| NA/mol |
| 56 |
| NA |
| 56 |
| NA |
| 224 |
| NA |
| m |
| V |
| m |
| ρ |
V=
| 224 |
| NA |
| 224 |
| aNA |
| 224 |
| aNA |
故答案为:
| 224 |
| aNA |
点评:本题把物质结构和性质与有机化合物的性质融合成一体,考查学生对元素推理、原子轨道杂化类型、分子空间结构、氢键、等电子体原理、晶胞结构等知识的掌握和应用能力.本题基础性较强,难度较大,注意晶胞体积的计算方法.

练习册系列答案
相关题目
 (1)(2011?江苏高考,节选)Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为 KOH 溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:
(1)(2011?江苏高考,节选)Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为 KOH 溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式: