题目内容
 (1)(2011?江苏高考,节选)Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为 KOH 溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:
(1)(2011?江苏高考,节选)Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为 KOH 溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:Ag2O2+2Zn+4KOH+2H2O═2K2Zn(OH)4+2Ag
Ag2O2+2Zn+4KOH+2H2O═2K2Zn(OH)4+2Ag
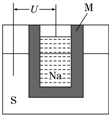
.(2)(2011?山东高考,节选)如图为钠高能电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+xS═Na2Sx,正极的电极反应式为
xS+2e-═Sx2-
xS+2e-═Sx2-
.M(由Na2O和Al2O3制得)的两个作用是导电和隔离钠与硫
导电和隔离钠与硫
.与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的4.5
4.5
倍.(3)(2011?新课标高考,节选)以甲醇为燃料的电池中,电解质溶液为酸性,负极的反应式为
CH3OH+H2O-6e-═CO2+6H+
CH3OH+H2O-6e-═CO2+6H+
,正极的反应式为| 3 |
| 2 |
| 3 |
| 2 |
96.6%
96.6%
(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比,甲醇的燃烧热为△H=-726.5kJ/mol).分析:(1)根据电池正、负极反应的物质和电解质溶液分析反应物和生成物,根据电子守恒进行配平;
(2)正极上得电子发生还原反应;熔融状态下,Na2O和Al2O3能电离出阴阳离子而使电解质导电,且钠易和硫反应;根据转移电子和负极质量的关系分析;
(3)甲醇酸性燃料电池中,负极上燃料失电子发生氧化反应,正极上氧气得电子发生还原反应,其产生的电能与燃烧放出的燃料的比即为燃料电池的理论效率.
(2)正极上得电子发生还原反应;熔融状态下,Na2O和Al2O3能电离出阴阳离子而使电解质导电,且钠易和硫反应;根据转移电子和负极质量的关系分析;
(3)甲醇酸性燃料电池中,负极上燃料失电子发生氧化反应,正极上氧气得电子发生还原反应,其产生的电能与燃烧放出的燃料的比即为燃料电池的理论效率.
解答:解:(1)根据题意知,碱性条件下,负极上锌失电子发生氧化反应,正极上Ag2O2得电子发生还原反应,
所以电池反应式为Ag2O2+2Zn+4KOH+2H2O═2K2Zn(OH)4+2Ag,
故答案为:Ag2O2+2Zn+4KOH+2H2O═2K2Zn(OH)4+2Ag;
(2)正极上硫得电子发生还原反应,所以正极电极反应式为:xS+2e-═Sx2-,熔融状态下,Na2O和Al2O3能电离出阴阳离子而使电解质导电,且钠易和硫反应,所以它起到隔离作用,
钠高能电池中负极为钠,有23g钠消耗释放1mol e-,则207g钠消耗时转移207/23mol e-,铅蓄电池的电极反应为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,铅蓄电池中铅是负极,207g铅消耗时转移 2mol e-,故钠硫电池的理论放电量是铅蓄电池的:207÷23÷2=4.5 倍,
故答案为:xS+2e-═Sx2-;导电和隔离钠与硫;4.5;
(3)甲醇燃料电池中,负极上甲醇失电子发生氧化反应,电极反应式为CH3OH+H2O-6e-═CO2+6H+
,正极上氧气得电子发生还原反应,电极反应式为
O2+6H++6e-═3H2O,
该燃料电池的理论效率=702.1kJ÷726.5kJ×100%=96.6%.
答案:CH3OH+H2O-6e-═CO2+6H+;
O2+6H++6e-═3H2O;96.6%.
所以电池反应式为Ag2O2+2Zn+4KOH+2H2O═2K2Zn(OH)4+2Ag,
故答案为:Ag2O2+2Zn+4KOH+2H2O═2K2Zn(OH)4+2Ag;
(2)正极上硫得电子发生还原反应,所以正极电极反应式为:xS+2e-═Sx2-,熔融状态下,Na2O和Al2O3能电离出阴阳离子而使电解质导电,且钠易和硫反应,所以它起到隔离作用,
钠高能电池中负极为钠,有23g钠消耗释放1mol e-,则207g钠消耗时转移207/23mol e-,铅蓄电池的电极反应为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,铅蓄电池中铅是负极,207g铅消耗时转移 2mol e-,故钠硫电池的理论放电量是铅蓄电池的:207÷23÷2=4.5 倍,
故答案为:xS+2e-═Sx2-;导电和隔离钠与硫;4.5;
(3)甲醇燃料电池中,负极上甲醇失电子发生氧化反应,电极反应式为CH3OH+H2O-6e-═CO2+6H+
,正极上氧气得电子发生还原反应,电极反应式为
| 3 |
| 2 |
该燃料电池的理论效率=702.1kJ÷726.5kJ×100%=96.6%.
答案:CH3OH+H2O-6e-═CO2+6H+;
| 3 |
| 2 |
点评:本题考查了原电池原理,明确正负极上得失电子及反应类型是解本题关键,难点是电极反应式的书写,注意结合电解质溶液的酸碱性书写,易错题是(2),根据M晶体的类型确定M的导电作用,难度很大.

练习册系列答案
相关题目



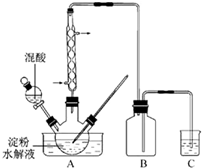 (2011?江苏)草酸是一种重要的化工产品.实验室用硝酸氧化淀粉水解液制备草酸的装置如图14所示(加热、搅拌和仪器固定装置均已略去)
(2011?江苏)草酸是一种重要的化工产品.实验室用硝酸氧化淀粉水解液制备草酸的装置如图14所示(加热、搅拌和仪器固定装置均已略去)

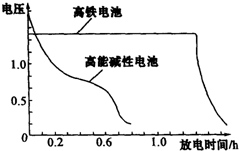 右图为该电池和常用的高能碱性
右图为该电池和常用的高能碱性