题目内容
25℃ 时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L HA酸溶液,溶液pH变化曲线如下图所示,仔细观察下图,判断有关说法中不正确的是( )
A.HA酸是弱酸
B.当滴定过程中溶液pH=7时,c(Na+)=c(A-)>c(OH-)=c(H+)
C.在C点:c(Na+)>c(A-)>c(H+)>c(OH-)
D.在D点:c(A-)+c(HA)=2c(Na+)
C
解析:根据酸和碱浓度及体积可知,当加入12.5mlHA时恰好中和,但此时溶液是显碱性的,说明生成物盐NaA要水解,A正确。根据电荷守恒可知c(Na+)+c(H+)=c(A-)+c(OH-),B正确,而C是错误的。25ml时,溶液中含有NaA和HA,且二者的浓度是相同的,所以根据原子守恒可知,D是正确的。答案选C。

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
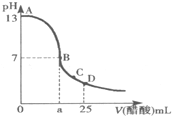 25℃时,在25mL 0.1mol?L-1的NaOH溶液中,逐滴加入0.2mol?L-1的CH3COOH溶液,溶液的pH与醋酸体积关系如图,下列分析正确的是( )
25℃时,在25mL 0.1mol?L-1的NaOH溶液中,逐滴加入0.2mol?L-1的CH3COOH溶液,溶液的pH与醋酸体积关系如图,下列分析正确的是( )
