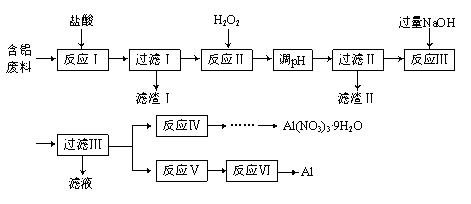
题目内容
【题目】资源的高效利用对保护环境、促进经济持续健康发展具有重要作用。磷尾矿主要含Ca5(PO4)3F和CaCO3·MgCO3 。某研究小组提出了磷尾矿综合利用的研究方案,制备具有重要工业用途的CaCO3、Mg(OH)2、P4和H2,其简化流程如下:

已知:①Ca5(PO4)3F在950℃不分解;
②4Ca5(PO4)3F+18SiO2+30C![]() 2CaF2+30CO+18CaSiO3+3P4
2CaF2+30CO+18CaSiO3+3P4
请回答下列问题:
(1)950℃煅烧磷尾矿生成气体的主要成分是___________。
(2)实验室过滤所需的玻璃仪器是_____________。
(3)NH4NO3溶液能从磷矿I中浸取出Ca2+的原因是__________。
(4)在浸取液II中通入NH3,发生反应的化学方程式是____________。
(5)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25℃,101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) △H=-271kJ/mol
5 CaO(s)+H3PO4(l)+HF(g)= Ca5(PO4)3F (s)+5H2O(l) △H=-937kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是_________________。
(6)在一定条件下CO(g)+H2O(g) ![]() CO2(g)+H2(g),当CO与H2O(g)的起始物质的量之比为1:5,达平衡时,CO转化了5/6.若akg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4,将产生的CO与H2O(g)按起始物质的量之比1:3混合,则相同条件下达平衡时能产生H2________kg。
CO2(g)+H2(g),当CO与H2O(g)的起始物质的量之比为1:5,达平衡时,CO转化了5/6.若akg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4,将产生的CO与H2O(g)按起始物质的量之比1:3混合,则相同条件下达平衡时能产生H2________kg。
【答案】(1)CO2
(2)漏斗、烧杯、玻璃棒。
(3)NH4+ 水解使溶液呈酸性,与CaO、Ca(OH)2反应生成Ca2+
(4)MgSO4+2NH3+2H2O===Mg(OH)2↓+(NH4)2SO4 。
(5)Ca5(PO4)3F (s)+ 5H2SO4(l)=5CaSO4(s) +H3PO4(l)+HF(g) △H=-418kJ/mol 。
(6)![]()
【解析】
试题分析:(1)根据题给化学工艺流程和信息①知磷尾矿[主要含Ca5(PO4)3F和CaCO3·MgCO3 ]在950℃下煅烧,其中碳酸钙和碳酸镁分解,生成气体的成分为二氧化碳(CO2)。
(2)实验室过滤所需的玻璃仪器是烧杯、漏斗和玻璃棒。
(3)NH4NO3溶液中铵离子水解呈酸性,与CaO、Ca(OH)2反应生成Ca2+。
(4)根据化学工艺流程判断浸取液II的主要成分为硫酸镁溶液,通入NH3,发生反应的化学方程式是MgSO4+2NH3+2H2O===Mg(OH)2↓+(NH4)2SO4 。
(5)已知25℃,101kPa时:
①CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) △H=-271kJ/mol
②5 CaO(s)+H3PO4(l)+HF(g)= Ca5(PO4)3F (s)+5H2O(l) △H=-937kJ/mol
根据盖斯定律:①×5—②得Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是Ca5(PO4)3F (s)+ 5H2SO4(l)=5CaSO4(s) +H3PO4(l)+HF(g) △H=-418kJ/mol 。
(6)根据题给数据利用三行式分析。设CO的起始浓度为1mol/L,则水蒸气的起始浓度为5mol/L
CO(g)+H2O(g) ![]() CO2(g)+H2(g),
CO2(g)+H2(g),
起始浓度(mol/L)1 5 0 0
转化浓度(mol/L)5/6 5/6 5/6 5/6
平衡浓度(mol/L)1/6 25/6 5/6 5/6
则K=c(CO2)c(H2)/c(CO)c(H2O)=1。相同条件下当CO与H2O(g)的起始物质的量之比为1:3,平衡常数不变,设转化的CO为x。
CO(g)+H2O(g) ![]() CO2(g)+H2(g),
CO2(g)+H2(g),
起始浓度(mol/L)1 3 0 0
转化浓度(mol/L)x x x x
平衡浓度(mol/L)(1-x) (3-x) x x
则x2/(1-x)(3-x)=1,解得x=3/4,即达平衡时,CO转化了3/4。转化为P4的Ca5(PO4)3F质量为a×10%×b%kg,根据反应4Ca5(PO4)3F+18SiO2+30C![]() 2CaF2+30CO+18CaSiO3+3P4知生成CO的质量为(30×28×a×10%×b%)/(4×504)kg,则转化的CO的质量为3(30×28×a×10%×b%)/4(4×504)kg,根据反应:CO(g)+H2O(g)
2CaF2+30CO+18CaSiO3+3P4知生成CO的质量为(30×28×a×10%×b%)/(4×504)kg,则转化的CO的质量为3(30×28×a×10%×b%)/4(4×504)kg,根据反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g)知相同条件下达平衡时能产生H23(30×28×a×10%×b%)/56(4×504)kg=
CO2(g)+H2(g)知相同条件下达平衡时能产生H23(30×28×a×10%×b%)/56(4×504)kg=![]() kg。
kg。

 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案【题目】氯气用于自来水的杀菌消毒,但在消毒时会产生一些负面影响,因此人们开始研究一些新型自来水消毒剂。某学习小组查阅资料发现NCl3可作为杀菌消毒剂,该小组利用下图所示的装置制备NCl3,并探究NCl3的漂白性。NCl3的相关性质如下:
物理性质 | 制备原理 | 化学性质 |
黄色油状液体,熔点为-40℃,沸点为71℃,不溶于冷水,易溶于有机溶剂,密度为1.65 g/mL | Cl2与NH4Cl水溶液在低温下反应 | 95℃爆炸,热水中发生水解 |

回答下列问题:
(1)根据实验目的,接口连接的顺序为1— — —2—3 —6—7 — — 。
(2)C装置中盛放的试剂为饱和食盐水,E装置中盛放的试剂为 。
(3)A装置中发生反应的离子方程式为 。
(4)B装置中发生反应的化学方程式为 ,当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为 。
(5)当F装置的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50-60℃热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,结合反应方程式解释该现象: 。