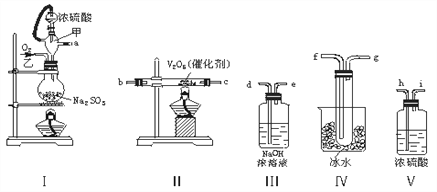
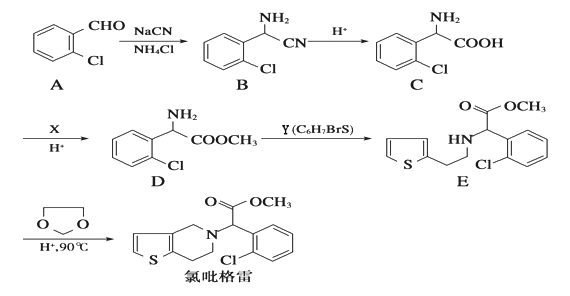
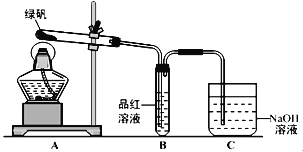
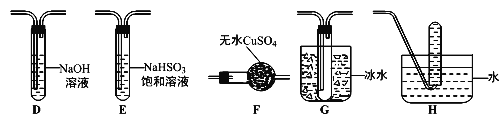
题目内容
【题目】25℃时,在10mL浓度均为0.1mol/L的NaOH和CH3COONa混合溶液中滴加0.1mol/L的盐酸,所得滴定曲线如图所示。下列说法正确的是
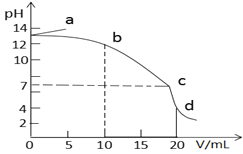
A. a点溶液加水稀释,![]() 逐渐增大
逐渐增大
B. b→c段发生反应的离子方程式是:CH3COO- + H+ = CH3COOH
C. c点时水的电离程度最大
D. d点溶液中c(Na+)=c(Cl-)>c(CH3COOH)>c(CH3COO-)>c(H+)
【答案】B
【解析】A. a点溶液中存在NaOH和CH3COONa,加水稀释c(OH-)减小,醋酸钠的水解程度增大,n(CH3COO-)减小,n(CH3COOH)增大,因此![]() 逐渐减小,故A错误;B.加入盐酸,首先发生中和反应,b点时氢氧化钠恰好完全反应生成氯化钠,随后发生醋酸钠与盐酸的反应,离子方程式是:CH3COO- + H+ = CH3COOH,故B正确;C.从 a点到b点过程中氢氧化钠的浓度逐渐减小,对醋酸钠的水解的抑制程度逐渐减小,到b点时,醋酸钠的水解受到抑制的程度最小,即醋酸钠的水解程度最大,此时水的电离程度最大,故C错误;D. d点溶液中存在CH3COOH和氯化钠, 浓度之比为1:2,此时为弱酸,在醋酸溶液中有c(H+)=c(CH3COO-)+ c(OH-),则 c(H+)>c(CH3COO-),故D错误;故选B。
逐渐减小,故A错误;B.加入盐酸,首先发生中和反应,b点时氢氧化钠恰好完全反应生成氯化钠,随后发生醋酸钠与盐酸的反应,离子方程式是:CH3COO- + H+ = CH3COOH,故B正确;C.从 a点到b点过程中氢氧化钠的浓度逐渐减小,对醋酸钠的水解的抑制程度逐渐减小,到b点时,醋酸钠的水解受到抑制的程度最小,即醋酸钠的水解程度最大,此时水的电离程度最大,故C错误;D. d点溶液中存在CH3COOH和氯化钠, 浓度之比为1:2,此时为弱酸,在醋酸溶液中有c(H+)=c(CH3COO-)+ c(OH-),则 c(H+)>c(CH3COO-),故D错误;故选B。

【题目】亚硝酸氯(ClNO)是有机合成中的重要试剂。亚硝酸氯可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K1
2NaNO3(s)+2NO(g)+Cl2(g) K1
②2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K2
NaNO3(s)+ClNO(g) K2
③2NO(g)+Cl2(g)![]() 2ClNO(g) K3
2ClNO(g) K3
则K1,K2,K3之间的关系为K3=______________。
(2)T℃时,2NO(g)+Cl2(g)![]() 2ClNO(g)的正反应速率表达式为v正= k cn(ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为v正= k cn(ClNO),测得速率和浓度的关系如下表:
序号 | c(ClNO)/mol·L-1 | v/mol·L-1·s-1 |
① | 0.30 | 3.6×10-8 |
② | 0.60 | 1.44×10-7 |
③ | 0.90 | 3.24×10-7 |
n=____________;k=____________(注明单位)。
(3)在2L的恒容密闭容器中充入4molNO(g)和2molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图A:
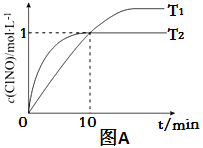
①温度为T1时,能作为该反应达到平衡的标志的有 ;
a.容器体积保持不变
b.容器压强保持不变
c.平衡常数K保持不变
d.气体颜色保持不变
e.v(ClNO)= v(NO)
f.NO与 ClNO的物质的量比值保持不变
②反应开始到10min时Cl2的平均反应速率v(Cl2)=____________;
③温度为T2时,10min已经达到平衡,该反应的平衡常数K=____________(注明单位)。
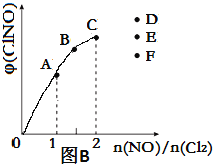
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数φ随n(NO)/n(Cl2)的变化图象如图B,则A、B、C三状态中,NO的转化率最小的是__________点,当n(NO)/n(Cl2)=2.8时,达到平衡状态ClNO的体积分数φ可能是D、E、F三点中的_________点。