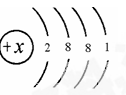
题目内容
四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,则对下列叙述的判断正确的是( )
①a-b=m-n
②元素的原子序数a>b>c>d
③元素非金属性Z>R
④最高价氧化物对应水化物的碱性X>Y
①a-b=m-n
②元素的原子序数a>b>c>d
③元素非金属性Z>R
④最高价氧化物对应水化物的碱性X>Y
| A.②③ | B.③ | C.①②③④ | D.①②③ |
D
试题分析:金属元素的原子失去电子变为阳离子,非金属元素的原子获得电子变为阴离子。原子失去或获得的电子越多,其所带的电荷就越多。根据题意可得:①a-m=b-n ,整理可得a-b=m-n。正确。由于这几种离子的电子层结构相同,Xm+、bYn+是阳离子,失去的电子m>n,所以原子序数a>b;cZn-和dRm-是阴离子,得到的电子m>n,所以原子序数c>d.。阳离子的原子序数大于阴离子的原子序数。所以元素的原子序数a>b>c>d.正确。③同一周期的元素,原子序数越大,元素非金属性越强,由于Z的原子序数大于R的原子序数,所以非金属性Z>R。正确。④同一周期的元素,原子序数越大,元素的金属性就越弱。原子序数X>Y。所以最是高价氧化物对应水化物的碱性Y>X。错误。

练习册系列答案
相关题目
 Si3N4(s) + 12HCl(g) △H<0
Si3N4(s) + 12HCl(g) △H<0