题目内容
某元素的同位素A ZX,它的氯化物XCl2 1.665g溶于水制成溶液后,加入0.5mol?L-1的AgNO3溶液60mL恰好完全反应.若这种同位素原子核内有20个中子,则:(1)X元素在周期表中的位置为______(2)把X的单质放入水中,现象为______,写出反应的化学方程式______
(3)写出计算Z值和A值的过程.
【答案】分析:根据两溶液反应的化学方程式求出氯化物的物质的量,然后再求氯化物的摩尔质量,根据氯化物的摩尔质量在数值上等于其相对分子质量,最后求出X的相对原子质量,而原子的相对原子质量=原子的质量数,根据质子数=质量数-中子数,再根据原子结构示意图推出在周期表中的位置,把X的单质与水反应.
解答:解:(1)XCl2 +2AgNO3 ═2AgCl↓+X(NO3)2
0.015 mol 0.5 mol?L-1×0.06L
则XCl2的摩尔质量=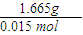 =111g/mol,XCl2的相对分子质量为111,
=111g/mol,XCl2的相对分子质量为111,
所以X的相对原子质量=110-35.5×2=40,即X的质量数为40,
因质子数=质量数-中子数=40-20=20,故X为Ca,位于第四周期第ⅡA族;
(2)金属钙能与水剧烈反应,放热,有气体放出,反应的方程式为Ca+2H2O═Ca(OH)2+H2↑,
故答案为:与水剧烈反应,放出大量的热,有气体生成;Ca+2H2O═Ca(OH)2+H2↑;
(3)由(1)可知:质子数(Z)=20,质量数(A)=40.
答:Z=20,A=40.
点评:本题考查学生利用化学反应、质量与物质的量的关系、原子中的数量关系来计算,难度不大,注重对基础知识的考查和训练.
解答:解:(1)XCl2 +2AgNO3 ═2AgCl↓+X(NO3)2
0.015 mol 0.5 mol?L-1×0.06L
则XCl2的摩尔质量=
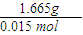 =111g/mol,XCl2的相对分子质量为111,
=111g/mol,XCl2的相对分子质量为111,所以X的相对原子质量=110-35.5×2=40,即X的质量数为40,
因质子数=质量数-中子数=40-20=20,故X为Ca,位于第四周期第ⅡA族;
(2)金属钙能与水剧烈反应,放热,有气体放出,反应的方程式为Ca+2H2O═Ca(OH)2+H2↑,
故答案为:与水剧烈反应,放出大量的热,有气体生成;Ca+2H2O═Ca(OH)2+H2↑;
(3)由(1)可知:质子数(Z)=20,质量数(A)=40.
答:Z=20,A=40.
点评:本题考查学生利用化学反应、质量与物质的量的关系、原子中的数量关系来计算,难度不大,注重对基础知识的考查和训练.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案
相关题目
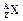 ,它的氯化物XCl2 1.11g溶于水制成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核
,它的氯化物XCl2 1.11g溶于水制成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核 内有20个中子,求:
内有20个中子,求: