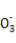题目内容
R、X、Y、M、Z五种短周期主族元素的原子半径依次减小,X、Y、Z的电子层数之和为5,X元素原子的最外层电子数是它的电子层数的2倍,Y元素原子的最外层电子数是X和Z两元素原子最外层电子数的总和,M是地壳中含量最多的元素,R与Z的最外层电子数相同。下列叙述正确的是( )
A.Z与M形成的化合物中不可能含有非极性键
B.对应氢化物的热稳定性:X>Y>M
C.单质的还原性:R>M>Y>X
D.X、Y、M、Z四种元素组成的离子化合物受热易分解
D
【解析】由于M是地壳中含量最多的元素,可确定M为O。又据“R、X、Y、M、Z的原子半径依次减小”且X、Y、Z的电子层数之和为5可知,Z为H,X、Y在第2周期,结合X最外层电子数是它电子层数的2倍可知,X为C,Y为N;又因R与Z的最外层电子数相同且是短周期元素,则R为Li或Na。Z(H)与M(O)形成的化合物有H2O和H2O2,后者含有非极性键,A项错误;非金属性:C<N<O,则气态氢化物的稳定性:H2O>NH3>CH4,B项错误;R、M、Y、X对应的单质分别为Li(Na)、O2、N2、C,显然C项错误;H、C、O、N组成的化合物为NH4HCO3或(NH4)2CO3,是离子化合物,受热易分解,D项正确。

练习册系列答案
相关题目