题目内容
【题目】NaBH4燃料电池具有理论电压高、能量密度大等优点。已知,能量密度=电池输出电能/燃料质量(已知电子的电荷量为1.6×10-19C),以该燃料电池为电源电解精炼铜的装置如图所示。下列说法不正确的是

A. 每消耗2.24 L O2(标准状况)时,A电极的质量减轻12.8 g
B. 离子交换膜应为阳离子交换膜,Na+由左极室向右极室迁移
C. 该燃料电池的负极反应式为BH4-+8OH--8e-=BO2- + 6H2O
D. 若NaBH4 燃料电池的电压为U伏,则此电池的能量密度为2.03×104UkJ·kg-1
【答案】A
【解析】分析:在碱性燃料电池中,通入NaBH4的一极为原电池的负极,发生氧化反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,通入O2的一极为原电池的正极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,A为电解池的阳极,发生氧化反应,B为电解池的阴极,发生还原反应,电极反应式为Cu2++2e-=Cu。
详解:A. A极为电解池的阳极,电解精炼铜时,A极材料为粗铜,则粗铜中含有的比铜活泼的金属如锌、铁等优先放电,而不只是铜放电,则每消耗2.24 L O2(标准状况)时,A电极减少的质量无法计算,故A 错误;
B. 由上述分析可知,左极室消耗氢氧根离子,钠离子为阳离子,由左极室向右极室迁移,所以离子交换膜应为阳离子交换膜,故B正确;
C. 该燃料电池的负极发生氧化反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,故C正确;
D. 能量密度=电池输出电能/燃料质量=![]() ,由电极反应式可知,1mol NaBH4反应时转移8mol电子,则此电池的能量密度为
,由电极反应式可知,1mol NaBH4反应时转移8mol电子,则此电池的能量密度为![]() =2.03×104UkJ·kg-1,故D正确;答案选A。
=2.03×104UkJ·kg-1,故D正确;答案选A。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案【题目】汽车尾气脱硝脱碳主要原理为2NO(g)+2CO(g)![]() N2(g)+2CO2(g) +Q(Q>0)。一定条件下密闭容器
N2(g)+2CO2(g) +Q(Q>0)。一定条件下密闭容器
中,用传感器测得该反应在不同时间 NO 和 CO 浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 |
c(NO)/molL-1 | 9.50×10-3 | 4.50×10-3 | 2.50×10-3 | 1.50×10-3 | 1.50×10-3 |
c(CO)/molL-1 | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
完成下列填空:
(1) 写出该反应的平衡常数表达式:_________。 温度升高,二氧化碳气体的浓度将______(填“变大”、“变小”或“不变”)。
(2)前 2s 内的氮气的平均反应速率是:v(N2)=______mol/(Ls);达到平衡时,CO 的转化率为:_____。
(3)工业上常采用“ 低温臭氧氧化脱硫脱硝” 技术来同时吸收 SO2 和氮的氧化物气体(NOx ),以获得(NH4)2SO4 的稀溶液。在此溶液中,水的电离程度是受到了_____(填“促进”、“抑制”或“没有影响”);
若往(NH4)2SO4溶液中再加入少量稀盐酸,则![]() 值将_____(填“变大”、“变小”或“不变”)。
值将_____(填“变大”、“变小”或“不变”)。
(4)如果向 BaCl2 溶液中通入足量 SO2 气体,没有沉淀生成,继续滴加一定量的氨水后,则会生成白色沉淀。用平衡移动原理解释上述现象:___________________________。
(5)向另一种可溶性钡盐溶液中通入少量 SO2 气体,会立即看到白色沉淀。该沉淀的化学式为_____; 原可溶性钡盐可能是_____。
【题目】1,2—二溴乙烷可作汽油抗爆剂的添加剂,实验室中用下图所示装置制备1,2—二溴乙烷。其中A和F中装有乙醇和浓硫酸的混合液,D中的试管里装有液溴。可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。(夹持装置已略去)
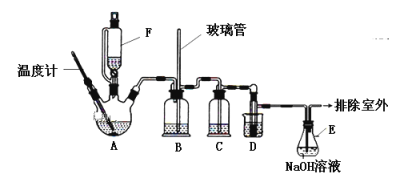
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度 / gcm-3 | 0.79 | 2.2 | 0.71 |
沸点 / ℃ | 78.5 | 132 | 34.6 |
熔点 / ℃ | 一l30 | 9 | —1l6 |
填写下列空白:
(1)A的仪器名称是__________________,
(2)A中发生反应的化学方程式为__________________________,D中发生反应的化学方程式为_____________________________________________________________;
(3)在装置C中应加入_________(填字母),其目的是吸收反应中可能生成的酸性气体;
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)若产物中有少量副产物乙醚,可用________________(填操作名称)的方法除去;
(5)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是___________________。