题目内容
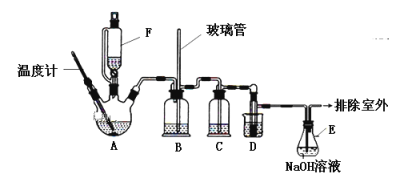
【题目】1,2—二溴乙烷可作汽油抗爆剂的添加剂,实验室中用下图所示装置制备1,2—二溴乙烷。其中A和F中装有乙醇和浓硫酸的混合液,D中的试管里装有液溴。可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。(夹持装置已略去)
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度 / gcm-3 | 0.79 | 2.2 | 0.71 |
沸点 / ℃ | 78.5 | 132 | 34.6 |
熔点 / ℃ | 一l30 | 9 | —1l6 |
填写下列空白:
(1)A的仪器名称是__________________,
(2)A中发生反应的化学方程式为__________________________,D中发生反应的化学方程式为_____________________________________________________________;
(3)在装置C中应加入_________(填字母),其目的是吸收反应中可能生成的酸性气体;
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)若产物中有少量副产物乙醚,可用________________(填操作名称)的方法除去;
(5)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是___________________。
【答案】三颈烧瓶 CH3CH2OH![]() CH2=CH2↑+H2OCH2=CH2+Br2→CH2BrCH2Br c蒸馏1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使导管堵塞
CH2=CH2↑+H2OCH2=CH2+Br2→CH2BrCH2Br c蒸馏1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使导管堵塞
【解析】
乙醇与浓硫酸的混合液加热到170℃发生消去反应生成CH2=CH2;由于浓硫酸具有强氧化性,乙醇具有还原性,浓硫酸与乙醇会发生氧化还原反应生成CO2、SO2、H2O,同时乙醇在浓硫酸存在140℃时脱水生成乙醚,所以制得的CH2=CH2中混有乙醚、CO2、SO2等杂质气体;由于SO2也能与Br2发生反应,所以气体在通入D中试管之前必须除去乙烯中混有的酸性气体。
(1)根据A的仪器的结构特点,A的仪器名称为三颈烧瓶。
(2)A中发生的主要反应为乙醇的消去反应,反应的化学方程式为CH3CH2OH![]() CH2=CH2↑+H2O。D中发生的反应为:乙烯与Br2加成制备1,2—二溴乙烷,反应的化学方程式为CH2=CH2+Br2→BrCH2CH2Br。
CH2=CH2↑+H2O。D中发生的反应为:乙烯与Br2加成制备1,2—二溴乙烷,反应的化学方程式为CH2=CH2+Br2→BrCH2CH2Br。
(3)由于浓硫酸具有强氧化性,乙醇具有还原性,浓硫酸与乙醇会发生氧化还原反应生成CO2、SO2、H2O,A中制得的CH2=CH2中混有CO2、SO2等气体,由于SO2也能与Br2反应,所以装置C中的试剂用于除去CH2=CH2中混有的酸性气体。a项,水不能将酸性气体完全吸收;b项,浓硫酸不能吸收CO2、SO2;c项,NaOH溶液能将CO2、SO2完全吸收;d项,饱和NaHCO3溶液只能吸收SO2,不能吸收CO2;要将生成的酸性气体完全吸收应选用NaOH溶液,答案选c。
(4)根据表中提供的1,2—二溴乙烷和乙醚的物理性质,1,2—二溴乙烷和乙醚为互相混溶、沸点差别较大的液体混合物,所以用蒸馏法除去1,2—二溴乙烷中少量的乙醚。
(5)根据表中提供的1,2—二溴乙烷的熔点,1,2—二溴乙烷的凝固点较低(9℃),若过度冷却,会使1,2—二溴乙烷凝固而使导管堵塞。

 阅读快车系列答案
阅读快车系列答案