题目内容
【题目】氮、磷及其化合物在生产、生活中有重要的用途。回答下列问题:
(1)在碱性条件下,次磷酸盐可用于化学镀银,完成其反应的离子方程式:
口H2PO2-+口Ag++口________=口PO43-+口Ag+口________
(2)由工业白磷(含少量砷、铁、镁等)制备高纯白磷(熔点44℃,沸点280℃),主要生产流程如下:
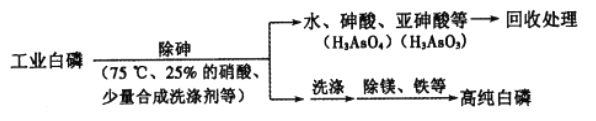
①关于除砷条件的说法合理的是__________(填字母)。
a.75℃使白磷熔化,并溶于水 b.硝酸浓度不易过大,防止白磷反应
c.温度不易过高,防止硝酸分解 d.适当提高温度,加快化学反应速率
②硝酸氧化除砷时被还原为NO,氧化相同质量的砷.当转化为亚砷酸的量越多,消耗硝酸的量越 _____________(填“多”或“少”)。
③某条件下,用一定量的硝酸处理一定量的工业白磷,砷的脱除率及磷的产率随硝酸质量分数的变化如右图,砷的脱除率从a点到b点降低的原因是_____________。

(3)某温度下,已知:
Ag+(aq)+2NH3(aq) ![]() Ag(NH3)2+(aq) k1=1.10×107
Ag(NH3)2+(aq) k1=1.10×107
AgCl(s)![]() Ag+(aq)+Cl-(aq) K2=1.45×10-10
Ag+(aq)+Cl-(aq) K2=1.45×10-10
①反应平衡常数的表达式K1=______________。
②计算可逆反应AgCl(s)+2NH3(aq)![]() Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=___________(保留2位有效数字)。
Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=___________(保留2位有效数字)。
③1Llmol/L氨水中最多可以溶解AgCl__________mol(保留1位有效数字,忽略溶液体积变化)。
【答案】
(1)lH2PO2-+4Ag++6OH-=lPO43-+4Ag+4H2O
(2)①bcd;②少;③硝酸浓度大,氧化性强,有较多的硝酸用于氧化白磷,脱砷率低。
(3)c[Ag(NH3)2+]/c(Ag+).c2(NH3);l.6×l0-3;0.04
【解析】
试题分析:(1)P元素化合价由+1价升高为+5价,共升高4价,而Ag元素由+1价降低为0甲,共降低1价,化合价升降最小公倍数为4,故H2PO2-、HPO43-的系数为1,Ag+、Ag的系数为4,碱性条件下进行反应,结合电荷守恒可知反应物中缺项为OH-,由元素守恒可知生成物中缺项为H2O,平衡后方程式为:1H2PO2-+4Ag++6OH-=1PO43-+4Ag+4H2O,故答案为:1H2PO2-+4Ag++6OH-=1PO43-+4Ag+4H2O;
(3)①a.白磷不溶于水,故a错误;b.硝酸具有强氧化性,硝酸浓度过大,能将白磷溶解,因此硝酸浓度不易过大,故b正确;c.温度过高,硝酸会分解,需要控制合适的温度,故c正确;d.提高温度可以加快反应速率,故d正确;故选:bcd;
②氧化相同质量的砷,转化为亚砷酸的量越多,转移电子数目越小,消耗硝酸越少,故答案为:少;
③硝酸浓度大,氧化性强,有较多的硝酸用于氧化白磷,脱砷率低,故答案为:硝酸浓度大,氧化性强,有较多的硝酸用于氧化白磷,脱砷率低;
(4)Ag+(aq)+2NH3(aq)![]() Ag(NH3)2+(aq)的平衡常数的表达式K=
Ag(NH3)2+(aq)的平衡常数的表达式K=![]() ,Ag+(aq)+2NH3(aq)
,Ag+(aq)+2NH3(aq)![]() Ag(NH3)2+(aq)与AgCl(s)
Ag(NH3)2+(aq)与AgCl(s)![]() Ag+(aq)+Cl-(aq)相加可以得到:AgCl(s)+2NH3(aq)Ag(NH3)2+(aq)+Cl-(aq),平衡常数表达式K=
Ag+(aq)+Cl-(aq)相加可以得到:AgCl(s)+2NH3(aq)Ag(NH3)2+(aq)+Cl-(aq),平衡常数表达式K=![]() =
=![]() ×c(Ag+)×c(Cl-)=1.10×107×1.45×10-10=1.6×10-3,计算溶解xmolAgCl,则Ag(NH3)2+为xmol/L,Cl-为xmol/L,溶液中NH3(aq)为(1-2x)mol/L,故
×c(Ag+)×c(Cl-)=1.10×107×1.45×10-10=1.6×10-3,计算溶解xmolAgCl,则Ag(NH3)2+为xmol/L,Cl-为xmol/L,溶液中NH3(aq)为(1-2x)mol/L,故![]() =1.6×10-3,解得x=0.04,故答案为:
=1.6×10-3,解得x=0.04,故答案为:![]() ;1.6×10-3;0.04。
;1.6×10-3;0.04。

 每课必练系列答案
每课必练系列答案