题目内容
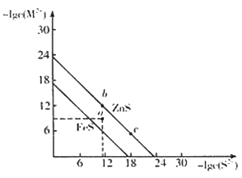
【题目】向20 mL 某浓度的AlCl3溶液中滴入2 mol·L-1的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:
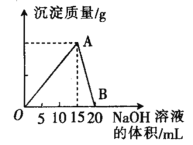
(1)图中A点表示的意义是______________。
(2)最大沉淀量是______________g。
(3)B点表示的意义是______________。
(4)所用AlCl3 溶液的物质的量浓度是______________。
(5)写出A~B段反应的离子方程式____________________________________
【答案】AlCl3与NaOH恰好完全反应,得到最大沉淀量 0.78 Al(OH)3与NaOH恰好完全反应生成NaAlO2,沉淀完全溶解 0.5mol/L Al(OH)3+OH-=AlO2-+2H2O
【解析】
NaOH溶液逐滴加入至AlCl3溶液中,开始时AlCl3和NaOH反应生成Al(OH)3沉淀,随着NaOH的继续滴入,Al(OH)3溶解生成NaAlO2,直至沉淀完全溶解,据此可分析解答问题。
(1)AlCl3和NaOH反应生成Al(OH)3沉淀,随着NaOH溶液的量逐渐增多,Al(OH)3量逐渐增大,到A点时NaOH将AlCl3恰好完全沉淀,故答案为:AlCl3与NaOH恰好完全反应,得到最大沉淀量;
(2)因为A→B消耗的NaOH溶液的体积为5mL,消耗NaOH的物质的量为0.005L×2mol/L=0.01mol,根据方程式Al(OH)3+NaOH=NaAlO2+2H2O可得,n[Al(OH)3]=0.01mol,
m[Al(OH)3]=0.01mol×78g/mol=0.78g,故答案为:0.78;
(3)随着NaOH的继续滴入,Al(OH)3溶解生成NaAlO2,B点表示Al(OH)3沉淀完全溶解,故答案为:Al(OH)3与NaOH恰好完全反应生成NaAlO2,沉淀完全溶解;
(4)根据铝原子守恒,则n(AlCl3)=n[Al(OH)3]=0.01mol,故氯化铝的物质的量浓度![]() ,故答案为0.5mol/L;
,故答案为0.5mol/L;
(5)A到B为Al(OH)3溶解生成NaAlO2,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O。