题目内容
下列四个实验中,结论正确的是( )
| A、有一澄清的碱性溶液,作离子鉴定时得出的结论是含有:AlO2-、Fe3+、HCO3- | B、某一固体溶于水后,检验出含有K+、NO3-、Na+、Cl-等离子,则该固体混合物是KNO3和NaCl的混合物或KCl和NaNO3的混合物 | C、固体NaOH吸收了空气中的二氧化碳并溶于水后,则溶液中含较多的HCO3- | D、某溶液中加入BaCl2出现不溶于稀HNO3的白色沉淀,则该溶液中一定含有SO42- |
分析:A、碱性溶液中Fe3+、HCO3-不能大量共存;
B、则该固体混合物是KNO3和NaCl的混合物或KCl和NaNO3的混合物溶于水溶液中都含有K+、NO3-、Na+、Cl-等离子;
C、固体NaOH吸收了空气中的二氧化碳,氢氧化钠必须大量;
D、某溶液中加入BaCl2出现不溶于稀HNO3的白色沉淀,则该溶液中可能含有Ag+、SO42-.
B、则该固体混合物是KNO3和NaCl的混合物或KCl和NaNO3的混合物溶于水溶液中都含有K+、NO3-、Na+、Cl-等离子;
C、固体NaOH吸收了空气中的二氧化碳,氢氧化钠必须大量;
D、某溶液中加入BaCl2出现不溶于稀HNO3的白色沉淀,则该溶液中可能含有Ag+、SO42-.
解答:解:A、碱性溶液中Fe3+、HCO3-不能大量共存,故A错误;
B、则该固体混合物是KNO3和NaCl的混合物或KCl和NaNO3的混合物溶于水,所得溶液中都含有K+、NO3-、Na+、Cl-等离子,故B正确;
C、固体NaOH吸收了空气中的二氧化碳,氢氧化钠必须大量,碱过量,碳酸氢根离子在碱性溶液中不能共存,故C错误;
D、某溶液中加入BaCl2出现不溶于稀HNO3的白色沉淀,则该溶液中可能含有Ag+或SO42-,但二者不能同时存在,故D错误;
故选B.
B、则该固体混合物是KNO3和NaCl的混合物或KCl和NaNO3的混合物溶于水,所得溶液中都含有K+、NO3-、Na+、Cl-等离子,故B正确;
C、固体NaOH吸收了空气中的二氧化碳,氢氧化钠必须大量,碱过量,碳酸氢根离子在碱性溶液中不能共存,故C错误;
D、某溶液中加入BaCl2出现不溶于稀HNO3的白色沉淀,则该溶液中可能含有Ag+或SO42-,但二者不能同时存在,故D错误;
故选B.
点评:本题考查离子能否共存的问题,离子能不能共存,就分析离子之间有无反应导致离子浓度的减小,这是关键.

练习册系列答案
相关题目
下列四个实验中,结论正确的是( )
| A.有一澄清的碱性溶液,做离子鉴定时得出的结论是含有:Al(OH) 4-、Fe3+、HCO3- |
| B.某一固体溶于水后,检验出含有K+、NO3-、Na+、Cl-等离子,则该固体混合物是KNO3和NaCl的混合物或KCl和NaNO3的混合物 |
| C.固体NaOH吸收了空气中的二氧化碳并溶于水后,则溶液中就一定大量存在碳酸根离子 |
| D.加热碳酸氢铵固体,将生成的气体通过碱石灰能制备NH3 |
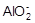 、Fe3+、
、Fe3+、
 、Na+、Cl-等离子, 则该固体混合物是KNO3和NaCl的混合物或KCl和NaNO3的混合物
、Na+、Cl-等离子, 则该固体混合物是KNO3和NaCl的混合物或KCl和NaNO3的混合物