题目内容
10.正确掌握化学用语是学好化学的基础,下列有关表述正确的是( )| A. | H、D、T互为同素异形体 | B. | 质量数为31的磷原子:${\;}_{15}^{31}$P | ||
| C. | 次氯酸的电子式: | D. | 乙烯的结构简式是:CH2CH2 |
分析 A.同种元素组成的不同单质为元素的同素异形体;
B.原子符号表示方法是把质量数标在元素符号左上角,质子数标在左下角,核电荷数=原子序数=质子数;
C.次氯酸中不存在氢氯键,其分子中存在1个氧氢键和1个氧氯键;
D.乙烯的结构简式中需要写出官能团.
解答 解:A、同素异形体研究的对象是单质,H、D、T是氢元素的不同核素,互为同位素,故A错误;
B.质量数为31的磷原子质子数为15,原子符号为:${\;}_{15}^{31}$P,故B正确;
C.次氯酸为共价化合物,分子中不存在氢氯键,次氯酸的电子式为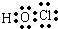 ,故C错误;
,故C错误;
D.乙烯的结构简式是CH2 =CH2,故D错误;
故选B.
点评 本题考查分子结构、常用化学用语书写、同素异形体、同位素等,题目难度中等,旨在考查学生对基础知识的掌握,注意次氯酸电子式的书写.

练习册系列答案
相关题目
6. 在25℃时,将 1.0L wmoI/L CH3COOH 溶液与 0.1mol NaOH固体混合,充分反应.然后向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示. 下列叙述正确的是( )
在25℃时,将 1.0L wmoI/L CH3COOH 溶液与 0.1mol NaOH固体混合,充分反应.然后向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示. 下列叙述正确的是( )
 在25℃时,将 1.0L wmoI/L CH3COOH 溶液与 0.1mol NaOH固体混合,充分反应.然后向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示. 下列叙述正确的是( )
在25℃时,将 1.0L wmoI/L CH3COOH 溶液与 0.1mol NaOH固体混合,充分反应.然后向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示. 下列叙述正确的是( )| A. | a、b、c对应的混合液中,水的电离程度由大到小的顺序是c>a>b | |
| B. | b点混合液中 c(Na+)>c(CH3COO-) | |
| C. | 加入CH3COOH过程中,$\frac{c(N{a}^{+})•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$增大 | |
| D. | 25℃时,CH3COOH的电离平衡常数Ka=$\frac{0.2×1{0}^{-7}}{w-0.1}$mol/L |
4. 0.10mol•L-1的稀醋酸中存在着平衡:CH3COOH?CH3COOˉ+H+.
0.10mol•L-1的稀醋酸中存在着平衡:CH3COOH?CH3COOˉ+H+.
①在图中a表示向稀醋酸中不断加水,b表示向稀醋酸中慢慢滴加0.10mol•Lˉ1的稀氢氧化钠溶液.a中醋酸电离百分率的变化图线已画出,请你图中画出b过程中醋酸电离百分率的变化图线.
②一定温度下,利用pH计测定不同浓度醋酸溶液的pH值,得到如下数据:
求该温度下醋酸的电离常数1.0×10-5.当醋酸浓度为0.1mol•L-1时,则电离度为1%.
 0.10mol•L-1的稀醋酸中存在着平衡:CH3COOH?CH3COOˉ+H+.
0.10mol•L-1的稀醋酸中存在着平衡:CH3COOH?CH3COOˉ+H+.①在图中a表示向稀醋酸中不断加水,b表示向稀醋酸中慢慢滴加0.10mol•Lˉ1的稀氢氧化钠溶液.a中醋酸电离百分率的变化图线已画出,请你图中画出b过程中醋酸电离百分率的变化图线.
②一定温度下,利用pH计测定不同浓度醋酸溶液的pH值,得到如下数据:
| 醋酸浓度(mol•L-1) | 1 | 0.1 | 0.01 |
| pH值 | 2.50 | 3.00 | 3.50 |
5.常温时,将不同体积比的NH3和CO2的混合气体溶于水得到一系列混合溶液,溶液中部分微粒的分布分数f[f=$\frac{某含C(或N)微粒浓度}{所有含C(或N)微粒浓度总和}$]随pH的变化曲线如图所示:下列说法正确的是( )


| A. | 当溶液pH=7时:c(NH4+)>c(H2CO3)+2c(CO32-) | |
| B. | 当溶液pH=9.5时:c(OH-)-c(H+)>c(NH4+)-3c(CO32-) | |
| C. | 若刚好是(NH4)2CO3溶液:c(OH-)+C(NH3•H2O)>c(H+)+c(H2CO3)+c(HCO3-) | |
| D. | 若刚好是NH4HCO3溶液,向其中加入等体积、等物质的量浓度的NaCl溶液,析出部分晶体,过滤所得的滤液中:c(Na+)=c(Cl-)>c(NH4+)>c(HCO3-)>c(CO32-) |
2.某学习小组为了探究Fe(NO3)3的热稳定性和氧化性,设计如下实验:
实验(一):热稳定性
利用如图装置进行实验,加热A中Fe(NO3)3固体,A和B中都有红棕色气体产生,A试管中生成了红色粉末.

(1)B装置的作用是防倒吸;检验A中红色固体Fe2O3,所用的试剂是HCl、KSCN(填化学式).
(2)加热A中试管一段时间后,C中导管口有气泡产生,而集气瓶中无气泡产生原因是NO2、O2恰好与氢氧化钠溶液完全反应.
(3)写出硝酸铁受热分解的化学方程式4Fe(NO3)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+12NO2↑+3O2↑.
实验(二):氧化性Fe3+和Ag+的氧化性相对强弱一直是实验探究的热点.该小组设计如下实验:
(4)设计实验a的目的是排除NO3-的干扰;实验c的结论是Fe3+能氧化Ag.
(5)实验b涉及反应的离子方程式为Fe2++Ag+?Fe3++Ag.
(6)实验结论是Fe3+、Ag+氧化性的相对强弱与离子的浓度有关.
实验(一):热稳定性
利用如图装置进行实验,加热A中Fe(NO3)3固体,A和B中都有红棕色气体产生,A试管中生成了红色粉末.

(1)B装置的作用是防倒吸;检验A中红色固体Fe2O3,所用的试剂是HCl、KSCN(填化学式).
(2)加热A中试管一段时间后,C中导管口有气泡产生,而集气瓶中无气泡产生原因是NO2、O2恰好与氢氧化钠溶液完全反应.
(3)写出硝酸铁受热分解的化学方程式4Fe(NO3)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+12NO2↑+3O2↑.
实验(二):氧化性Fe3+和Ag+的氧化性相对强弱一直是实验探究的热点.该小组设计如下实验:
| 试验编号 | 实验操作 | 现象 |
| a | 向10mL 3mol•L-1KNO3酸性溶液(pH=1)中插入一根洁净的银丝,并滴加氯化钠溶液 | 无沉淀生成 |
| b | 向10mL 3mol•L-1AgNO3溶液中滴加2mL 0.1mol•L-1FeSO4溶液,振荡;再滴加酸性高锰酸钾溶液 | 紫红色溶液不褪色 |
| c | 向10mL 3mol•L-1Fe(NO3)3溶液(pH=1)中插入一根洁净的银丝,并滴加氯化钠溶液 | 产生白色沉淀 |
(5)实验b涉及反应的离子方程式为Fe2++Ag+?Fe3++Ag.
(6)实验结论是Fe3+、Ag+氧化性的相对强弱与离子的浓度有关.
2.表是25℃时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是( )
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
| Ksp或Ka | Ksp=1.8×10-10 | Ksp=2×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向0.1mol•L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=9:5,此时溶液pH=5 | |
| C. | 碳酸钠溶液中滴加少量氯水的离子方程式是2CO32-+Cl2+H2O═2HCO3-+Cl-+ClO- | |
| D. | 向浓度均为1×10-3mol•L-1的KCl和K2CrO4混合液中滴加1×10-3mol•L-1的AgNO3溶液,CrO42-先形成沉淀 |
 ,与CO互为等电子体且带1个单位负电荷的阴离子化学式为CN-.
,与CO互为等电子体且带1个单位负电荷的阴离子化学式为CN-.
