题目内容
【题目】MnO2是一种重要的化工原料,工业上用粗MnO2(含有较多的MnO和MnCO3)样品转化为较纯净MnO2的流程如图所示:
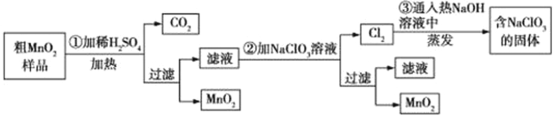
(1)第①步反应中的硫酸能否用浓盐酸代替? (填“能”或“否”),理由是 。
(2)第②步操作中,氧化性强弱顺序:![]() MnO2(填“>”或“<”),写出操作②中发生反应的离子方程式: ;当反应中转移2 mol电子时,生成的氧化产物的物质的量为 mol。
MnO2(填“>”或“<”),写出操作②中发生反应的离子方程式: ;当反应中转移2 mol电子时,生成的氧化产物的物质的量为 mol。
(3)工业上用MnO2为原料制取KMnO4,第一步将MnO2和KOH粉碎,混匀,在空气中加热至熔化,并连续搅拌,制取K2MnO4;第二步将K2MnO4挡板浓溶液用惰性电极进行电解,在阳极上得到KMnO4,在阴极上得到KOH。
①制取K2MnO4的化学反应方程式为 ,工业上不断搅拌的目的是 。
②电解K2MnO4的浓溶液时,电解的总反应方程式为 。
(4)二氧化锰含量可用碘量法测定,其原理为在盐酸介质中,二氧化锰能定量地将碘离子氧化成碘,以淀粉为指示剂用0.1000 mol/L硫代硫酸钠标准溶液滴定碘而确定二氧化锰含量:
MnO2+4HCl+2KI![]() MnCl2+I2+2KCl+2H2O
MnCl2+I2+2KCl+2H2O
I2+2Na2S2O3![]() 2NaI+Na2S4O6
2NaI+Na2S4O6
取较为纯净的二氧化锰样品a g加入到适量的盐酸和KI溶液中,反应完毕用Na2S2O3滴定反应后的溶液,消耗V mL Na2S2O3溶液,则该样品中MnO2含量为 %(杂质不参与反应)。
【答案】(1)否 浓盐酸能被MnO2氧化生成Cl2
(2)> 5Mn2++2![]() +4H2O
+4H2O![]() 5MnO2+Cl2↑+8H+ 1
5MnO2+Cl2↑+8H+ 1
(3)①2MnO2+4KOH+O2![]() 2 K2MnO4+2H2O 使反应物与O2充分接触
2 K2MnO4+2H2O 使反应物与O2充分接触
②2 K2MnO4+2H2O![]() 2KMnO4+2KOH+H2↑
2KMnO4+2KOH+H2↑
(4)![]()
【解析】本题考查考查氧化还原反应的有关知识、滴定方法在物质纯度的测定的应用的知识。(1)第①步反应中的硫酸不能用浓盐酸代替稀硫酸,这是因为MnO2具有氧化性,会将浓盐酸在加热时氧化产生氯气;
(2)在酸性条件下NaClO3可以将Mn2+氧化产生MnO2,其本身被还原产生Cl2,根据物质的氧化性:氧化剂>氧化产物可知“物质的氧化性:![]() >MnO2;根据电子守恒、电荷守恒和原子守恒,可知操作②中发生反应的离子方程式:5Mn2++2
>MnO2;根据电子守恒、电荷守恒和原子守恒,可知操作②中发生反应的离子方程式:5Mn2++2![]() +4H2O
+4H2O![]() 5MnO2 + Cl2↑+8H+;根据方程式可知:每反应产生5 mol氧化产物MnO2,转移电子的物质的量是10 mol,则当反应中转移2 mol电子时,生成的氧化产物的物质的量为1 mol。
5MnO2 + Cl2↑+8H+;根据方程式可知:每反应产生5 mol氧化产物MnO2,转移电子的物质的量是10 mol,则当反应中转移2 mol电子时,生成的氧化产物的物质的量为1 mol。
(3)①MnO2和KOH粉碎,混匀,在空气中加热至熔化,并连续搅拌,制取K2MnO4,则制取K2MnO4的化学反应方程式为2MnO2+4KOH+O2![]() 2 K2MnO4+2H2O;工业上不断搅拌的目的是使反应物与O2充分接触,发生反应,以提高原料的利用率;②将K2MnO4挡板浓溶液用惰性电极进行电解,在阳极上得到KMnO4,在阴极上得到KOH。电解K2MnO4的浓溶液时,电解的总反应方程式为2K2MnO4+2H2O
2 K2MnO4+2H2O;工业上不断搅拌的目的是使反应物与O2充分接触,发生反应,以提高原料的利用率;②将K2MnO4挡板浓溶液用惰性电极进行电解,在阳极上得到KMnO4,在阴极上得到KOH。电解K2MnO4的浓溶液时,电解的总反应方程式为2K2MnO4+2H2O![]() 2KMnO4+2KOH+H2↑;
2KMnO4+2KOH+H2↑;
(4)根据反应方程式MnO2+ 4HCl+2KI![]() MnCl2+I2+2KCl+2H2O ,I2+2Na2S2O3
MnCl2+I2+2KCl+2H2O ,I2+2Na2S2O3![]() 2NaI+Na2S4O6可得关系式:MnO2~I2~2Na2S2O3,n(Na2S2O3)= 0.1000 mol/L×V×103L=V×104 mol;则n(MnO2)=5V×105 mol,m(MnO2)=4.35V×103 g,则该样品中MnO2含量为(4.35V×103 g÷a g)×100%=
2NaI+Na2S4O6可得关系式:MnO2~I2~2Na2S2O3,n(Na2S2O3)= 0.1000 mol/L×V×103L=V×104 mol;则n(MnO2)=5V×105 mol,m(MnO2)=4.35V×103 g,则该样品中MnO2含量为(4.35V×103 g÷a g)×100%=![]() 。
。

