题目内容
准确称取6克铝土矿样品(含Al2O3、Fe2O3、SiO2)加入100mL硫酸溶液,充分反应后,向滤液中加入10mol/L NaOH溶液,产生沉淀的质量与加入NaOH溶液的体积关系如图所示,求所用硫酸溶液的物质的量浓度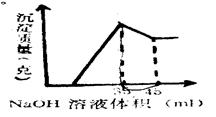
| A.1.75 mol/L | B.3.5 mol/L | C.2.25 mol/L | D.无法计算 |
A
解析试题分析:向含Al2O3、Fe2O3、SiO2加入硫酸溶液,Al2O3、Fe2O3发生反应得到含Fe2(SO4)3和Al2(SO4)3溶液,而SiO2不反应,仍然是固体。再向滤液中加入10mol/L NaOH溶液,由于开始无沉淀,说明硫酸过量,首先发生酸碱中和反应,然后发生反应:Al3++3OH-= Al(OH)3↓;Fe3++3OH-= Fe(OH)3↓;当二者沉淀完全,再发生反应:Al(OH)3+ OH-= AlO2-+ 2H2O。所以沉淀又逐渐溶解。当Al(OH)3溶解完全,沉淀达到最小值。当沉淀达到最大值时溶液为Na2SO4溶液,此时消耗NaOH的物质的量为0.035L×10mol/L=0.35mol,所以根据微粒守恒可得n(H2SO4)=0.35mol÷2=0.175mol,由于V(H2SO4)=0.1L,所以c(H2SO4)=0.175mol÷0.1L=1.75mol/L。因此选项为A。
考点:考查图像法在物质发生反应的计算中的应用的知识。

同温同压下某瓶充满O2时重116g,充满CO2时重122g,充满某气体时重132g,则该未知气体的相对分子质量为( )
| A.28 | B.64 | C.32 | D.44 |
设阿伏加德罗常数的值为NA,则下列说法正确的是
| A.标准状况下,11.2L CCl4所含的分子数为0.5NA |
| B.常温常压下,4.2g C2H4和C8H16的混合物中含有的碳原子数为0.3NA |
| C.7.8g苯分子中碳碳双键的数目为0.3 NA |
| D.6.4gCu与20mL10 mol·L-1浓硫酸反应,转移的电子数为0.2NA |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.标准状况下,2.24 L NH3分子中共价键数目为0.3 NA |
| B.1 L 1 mol·L-1H2O2溶液中氧原子数目为2 NA |
| C.25℃时,pH=7的纯水中OH-数目为1×10-7 NA |
| D.1 L 0.1 mol·L-1NH4Cl溶液中NH4+数目为0.1 NA |
下列相关表达正确的是
| A.亚硫酸的电离方程式:H2SO3=2H++SO2- 3 |
| B.中子数为18的氯原子的原子符号:18 17Cl |
| C.(CH3)2CHCH2CH2OH的名称:3-甲基-1-丁醇 |
D.HOCH2COOH缩聚产物的结构简式: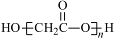 |
某种氯原子的质量是a g,12C原子的质量是b g,用NA表示阿伏加德罗常数,下列说法正确的是
A.氯元素的相对原子质量是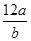 | B.m g该氯原子的物质的量是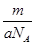 mol mol |
| C.该氯原子的摩尔质量是a NA g/mol | D.a g该氯原子所含质子数是17NA |
化学科学需要借助化学专用语言描述,下列有关化学用语正确的是 ( )
A.H2O的电子式: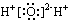 | B.质量数为14的碳原子: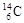 |
C.CO2的比例模型: | D.Cl-的结构示意图: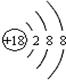 |
下列化学用语不能正确解释相关事实的是
A.碱性氢氧燃料电池的正极反应:H2 - 2e- + 2OH-="==" 2H2O  | B.用电子式表示NaCl的形成过程: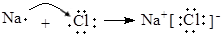 催化剂 |
| C.向含有Hg2+的废水中加入Na2S可除去Hg2+:Hg2+ + S2- ="==" HgS↓ | D.汽车尾气系统的催化转化器可降低NO等的排放:2CO+ 2NO ="==" 2CO2 +N2 |
(4分)(2012?广东)设nA为阿伏加德罗常数的数值,下列说法正确的是( )
| A.常温下,4g CH4含nA个C﹣H共价键 |
| B.1 mol Fe与足量稀HNO3反应,转移个2nA个电子 |
| C.1L 0.1 mol/L NaHCO3溶液中含有0.1nA个HCO3﹣ |
| D.常温常压下,22.4L的NO2和CO2混合气体含有2nA个O原子 |