题目内容
有a、b、c、d四种元素,a、b的阳离子和c、d的阴离子电子层结构相同,已知b的阳离子半径大于a的阳离子半径;c的阴离子比d的阴离子还原能力强,则四种元素的原子序数大小关系是 ( )。
| A.a>b>d>c | B.b>a>c>d | C.b>a>d>c | D.c>b>a>d |
A
解析

练习册系列答案
相关题目
元素周期律和元素周期表是学习化学的重要工具,下列叙述不正确的是( )
| A.从左到右,元素周期表中的第13列为ⅢA族 |
| B.某ⅡA族元素的原子序数为x ,则与它同周期的ⅢA族元素的原子序数可能为x+25 |
| C.ⅥA族元素,随原子半径增大,对应气态氢化物的稳定性逐渐增强 |
| D.53号元素位于周期表P区、第五周期ⅦA族。 |
下列有关元素及其化合物性质的比较正确的是
| A.原子半径:F<O<Al | B.稳定性:H2O<PH3<NH3 |
| C.酸性:H2CO3<H2SO4<H3PO4 | D.碱性:LiOH<NaOH<Al(OH)3 |
元素的原子半径在周期表中呈现周期性变化的根本原因是( )。
| A.原子的相对原子质量呈现周期性变化 |
| B.元素的化合价呈现周期性变化 |
| C.原子的性质呈现周期性变化 |
| D.元素原子的核外电子排布呈周期性变化 |
下列说法中正确的是( )。
| A.在周期表中金属与非金属的分界处可以找半导体材料 |
| B.H2S、H2Se、HF的热稳定性依次增强 |
| C.NaOH、KOH、Mg(OH)2的碱性依次减弱 |
| D.Cl、S、N元素的非金属性依次增强 |
几种短周期元素的原子半径和主要化合价见下表,下列说法中正确的是( )。
| 元素代号 | 原子半径/nm | 主要化合价 |
| X | 0.160 | +2 |
| Y | 0.143 | +3 |
| Z | 0.102 | +6、-2 |
| L | 0.099 | +7、-1 |
| M | 0.077 | +4、-4 |
| Q | 0.074 | -2 |
A.等物质的量的X、Y的单质与足量的盐酸反应,生成的H2一样多
B.Y与Q形成的化合物不能跟氢氧化钠溶液反应
C.Z的氢化物的稳定性强于L的氢化物的稳定性
D.在化学反应中,M原子与其他原子易形成共价键而不易形成离子键
核电荷数大于10的某短周期元素,其原子最外电子层所含有的电子数是次外层所含有的电子数的一半,有关该元素的单质或化合物的描述不正确的是( )。
| A.该元素在第3周期第ⅣA族 |
| B.该元素的单质在常温下性质稳定,不易与水反应 |
| C.该元素的氧化物不与酸反应,可与强碱的水溶液反应 |
| D.该元素在地壳中的含量大,居所有元素的第二位 |
据科学家预测,月球的土壤中吸附着数百万吨的 He,每百吨
He,每百吨 He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以
He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以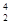 He的形式存在。下列说法正确的是( )。
He的形式存在。下列说法正确的是( )。
A.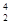 He原子核内含有4个质子 He原子核内含有4个质子 |
B. He和 He和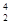 He互为同位素 He互为同位素 |
C. He原子核内含有3个中子 He原子核内含有3个中子 |
D.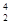 He的最外层电子数为2,所以 He的最外层电子数为2,所以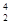 He具有较强的金属性 He具有较强的金属性 |
核电荷数为1~18的元素中,下列说法正确的是( )
| A.最外层只有1个电子的元素一定是金属元素 |
| B.最外层有2个电子的元素一定是金属元素 |
| C.原子核外各层电子数相等的元素一定是金属元素 |
| D.最外层电子数为7的原子,最高正价为+7 |