题目内容
表示0.1mol/L NaHCO3溶液中有关微粒浓度大小的关系式,正确的是( )
分析:NaHCO3是强碱弱酸酸式盐,HCO3-既能水解又能电离,HCO3-水解导致溶液中c(OH-)>c(H+)而使溶液呈碱性,溶液呈碱性说明HCO3-水解程度大于电离程度,根据溶液中电荷守恒分析溶液中各种离子浓度相对大小,注意碳酸氢根离子的水解和电离都较微弱.
解答:解:A、NaHCO3是强碱弱酸酸式盐,水溶液呈碱性,所以溶液中c(OH-)>c(H+),故A错误;
B、溶液呈电中性,阴阳离子所带电荷相等,即c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故B正确;
C、NaHCO3溶液呈碱性,说明HCO3-水解程度大于电离程度,所以c(H2CO3)>c(CO32-),故C错误;
D、溶液中HCO3-水解程度大于HCO3-电离程度,且水解和电离程度都较小,主要以HCO3-形式存在,则c(HCO3-)>c(H2CO3),故D错误.
故选B.
B、溶液呈电中性,阴阳离子所带电荷相等,即c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故B正确;
C、NaHCO3溶液呈碱性,说明HCO3-水解程度大于电离程度,所以c(H2CO3)>c(CO32-),故C错误;
D、溶液中HCO3-水解程度大于HCO3-电离程度,且水解和电离程度都较小,主要以HCO3-形式存在,则c(HCO3-)>c(H2CO3),故D错误.
故选B.
点评:本题考查离子浓度的大小比较,题目难度中等,注意把握弱电解质的电离和盐类水解的原理,从守恒的角度比较离子浓度大小是常用的方法.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
室温时,下列各表述与示意图一致的是( )
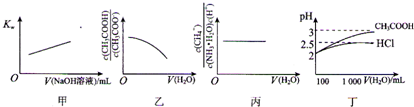

| A、图甲表示在纯水中加入0.01 moL?L-1 NaOH溶液,Kw与NaOH溶液体积变化关系 | ||
B、图乙表示将1 mol?L-1 CH3COONa溶液加水稀释,溶液中
| ||
C、图丙表示0.1mol?L-1 NH3?H2O加水稀释,溶液中
| ||
| D、图丁表示100 mL pH=2的HCl和CH3COOH加水稀释到1000mL时pH变化与水的体积的变化关系 |