题目内容
在100g炭不完全燃烧所得气体中CO和CO2的体积比为1:2.已知:C(s)+ O2(g)=CO(g);△H1=-110.35kJ/mol;CO(g)+
O2(g)=CO(g);△H1=-110.35kJ/mol;CO(g)+ O2=CO2(g);△H2=-282.57kJ/mol;则与100g炭完全燃烧相比,损失的热量是( )
O2=CO2(g);△H2=-282.57kJ/mol;则与100g炭完全燃烧相比,损失的热量是( )A.392.93kJ
B.2489.42kJ
C.784.92kJ
D.3274.3kJ
【答案】分析:100g炭完全燃烧相比,损失的热量是生成了一氧化碳导致的,可以先根据碳原子守恒和体积比为1:2计算出CO和CO2的物质的量,根据一氧化碳的物质的量,计算出一氧化碳燃烧成二氧化碳放出的热量就是损失的热量.
解答:解:n(C)=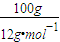 =
=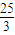 mol,CO和CO2的体积比为1:2,物质的量之比是1:2,根据碳原子守恒,n(CO)=
mol,CO和CO2的体积比为1:2,物质的量之比是1:2,根据碳原子守恒,n(CO)= ×
× =
= mol;
mol;
生成的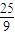 molCO燃烧生成二氧化碳放出的热量是:282.57kJ/mol×
molCO燃烧生成二氧化碳放出的热量是:282.57kJ/mol×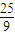 mol≈784.92kJ,故C正确;
mol≈784.92kJ,故C正确;
故选C.
点评:本题考查有关反应热的计算,根据所学知识完成即可,难度中等.
解答:解:n(C)=
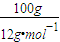 =
=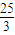 mol,CO和CO2的体积比为1:2,物质的量之比是1:2,根据碳原子守恒,n(CO)=
mol,CO和CO2的体积比为1:2,物质的量之比是1:2,根据碳原子守恒,n(CO)= ×
× =
= mol;
mol;生成的
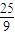 molCO燃烧生成二氧化碳放出的热量是:282.57kJ/mol×
molCO燃烧生成二氧化碳放出的热量是:282.57kJ/mol×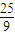 mol≈784.92kJ,故C正确;
mol≈784.92kJ,故C正确;故选C.
点评:本题考查有关反应热的计算,根据所学知识完成即可,难度中等.

练习册系列答案
相关题目
在100g炭不完全燃烧所得气体中CO和CO2的体积比为1:2.已知:
C(s)+1/2O2(g)=CO(g);△H1=-110.35kJ/mol
CO(g)+1/2O2= CO2(g);△H2=-282.57kJ/mol
则与100g炭完全燃烧相比,损失的热量是
| A.392.93kJ | B.2489.42kJ | C.784.92kJ | D.3274.3kJ |