题目内容
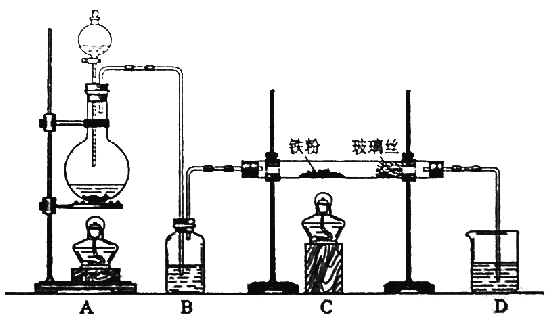
【题目】过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。
测定过氧化氢的含量请填写下列空白:
(1)移取10.00 m密度为ρ g·mL-1的过氧化氢溶液至250mL______________(填仪器名称)中,加水衡释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,己知MnO4-被还原成Mn2+。写出反应的离子方程式:_____________________________
(3)滴定时,将高锰酸钾标准溶液注入_________(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是_______________________________________。
(4)反复滴定三次,平均耗用c mol·L-1 KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为__________________。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________(填“偏高”或“偏低”或“不变”)。
【答案】 容量瓶 2MnO42-+5H2O2+6H+=2Mn2++8H2O+5O2↑ 酸式 滴入最后一滴高锰酸钾溶液,溶液呈紫红色,且30秒内不褪色 ![]() 偏高
偏高
【解析】(1)仪器的选用根据题意应该选用容量瓶;(2)残缺方程式配平首先确定缺什么,分析可知缺的是O2,根据电子转移守恒,配平化学方程式为:2MnO42-+5H2O2+6H+=2Mn2++8H2O+5O2↑;(3)由于高锰酸钾标准溶液具有强氧化性,所以只能使用酸式滴定管。滴定到达终点的现象是:滴入最后一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色;(4)根据反应2MnO42-+5H2O2+6H+=2Mn2++8H2O+5O2↑可知:2MnO42-![]() 5H2O2,则过氧化氢的质量分数=
5H2O2,则过氧化氢的质量分数=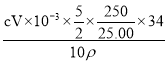 =
=![]() ;(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,有一部分溶液占据了气泡的体积,并没有滴入锥形瓶,则测定结果偏高。
;(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,有一部分溶液占据了气泡的体积,并没有滴入锥形瓶,则测定结果偏高。

 优质课堂快乐成长系列答案
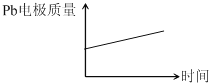
优质课堂快乐成长系列答案【题目】增强铝的耐腐蚀性,现以铅蓄电池以外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使表面表面的氧化膜增厚。反应原理如下:电池:Pb(s)+PbO2(s)+2H2SO4(aq)═2PbSO4(s)+2H2O(I)
电解池:2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下判断正确的是
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e-═Pb2++2H2O | 阳极:2Al+3H2O-6e-═Al2O3+6H+ |
D |
|
|
A. A B. B C. C D. D