题目内容
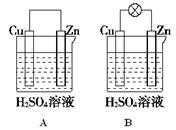
(8分)观察图A、B,回答下列问题:
(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片,可观察到铜片________(填“有”或“没有”)气泡产生。再用导线把锌片和铜片连接起来(见图A),组成一个原电池,正极的电极反应式为_________________________。
(2)如果烧杯中最初装入的是500 mL 2 mol·L-1的稀硫酸溶液,构成铜锌原电池(见图B,假设产生的气体没有损失,锌失去的电子完全沿导线到铜电极),当在标准状况下收集到11.2 L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度分别为(溶液体积变化忽略不计)____________,________________。
(1)没有 2H++2e-===H2↑
(2)c(H2SO4)=1 mol·L-1 c(ZnSO4)=1 mol·L-1
解析:考查电化学的应用。
(1)铜在金属活动顺序表中,排在氢的后面。和酸不能生成氢气。如果用导线把锌和铜连接起来插入稀硫酸中,则构成原电池,锌是负极,铜是正极,溶液中的氢离子在正极得到电子,发生还原反应生成氢气,电极反应式2H++2e-===H2↑。
(2)500 mL 2 mol·L-1的稀硫酸是0.5L×2mol/.L=1.0mol,标准状况下11.2 L的氢气是0.5mol。该反应的总反应式为Zn+H2SO4=ZnSO4+H2↑,所以消耗硫酸是0.5mol,生成硫酸锌是0.5mol,剩余硫酸是0.5mol,所以此时烧杯内溶液中溶质的物质的量浓度都是![]() 。
。

练习册系列答案
相关题目