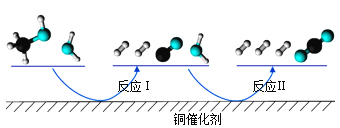
题目内容
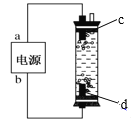
【题目】(1)“84”消毒液是一种常用的消毒剂,其有效成分是______(填化学式)。某学生用石墨作电极电解饱和氯化钠溶液,制作了一种家用环保型消毒液发生器,如图所示。电极c处发生反应的离子方程式依次为:2H2O+2e-=H2↑+2OH-;_____。
(2)“84”消毒液工业品中常含有1.5%~3%的NaOH,其目的一是使平衡_____(写出离子方程式)向逆方向移动;二是吸收空气中的_____(填化学式)防止消毒液失效。
(3)消毒液中氯元素的存在形态与溶液pH的关系如下:
溶液pH | >9 | 5~6 | 4~5 | 2~3 | <2 |
主要成分 | NaClO | HClO与NaClO(少量) | HClO与Cl2(少量) | HClO与Cl2 | Cl2 |
请你写出pH降低时产生氯气的离子方程式:_____。
(4)某同学猜测“84消毒液”(以下简称“84”)可以“漂白”米醋,进行了实验1和实验2:
编号 | 实验操作 | 实验现象 |
实验1 |
滴加2滴米醋,5滴管“84” | 溶液无色,闻到刺激性气味 |
实验2 |
滴加2滴米醋,5滴管蒸馏水 | 溶液为浅棕色,无刺激性气味 |
实验2的目的是:①______;②______。
为进一步研究“84”与米醋的反应,该同学又进行了以下实验:
编号 | 实验操作 | 实验现象 |
实验3 |
逐滴加入“84”,10滴米醋 | “84”滴入后迅速产生刺激性气味的气体;滴加至5滴时,溶液开始褪色;滴加至21滴时,褪为淡黄色;继续滴加不再出现明显褪色。 |
实验4 |
逐滴加入米醋,21滴“84” | 滴入米醋后立即褪色;当米醋滴加至10滴时,溶液较实验3颜色更浅;当米醋加至17滴时,与实验3中溶液最终颜色相同。 |
请你结合上述实验和相关资料,分析实验3与实验4现象的差异:______。
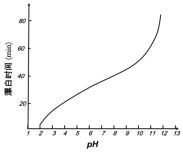
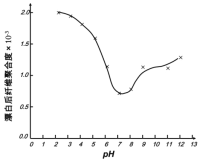
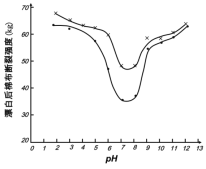
(5)某工厂使用次氯酸钠漂白棉布,该工厂对生产条件进行了研究,结果如图所示:
查阅资料得知:次氯酸钠对纤维素的破坏分为两个阶段进行。第一阶段:纤维素纤维的羟基与次氯酸作用生成次氯酸酯;第二阶段:生成的次氯酸酯在OH-离子作用下,失去一分子氯化氢,并转变为醛或酮,直接影响纤维素化学键的稳定性。
①当溶液pH=7时,纤维聚合度最低,纤维损伤最严重的原因是:_____。
②综合考虑,生产过程中pH最好选择_____,理由是_____。
【答案】NaClO Cl2+2OHˉ=Clˉ+ClOˉ+H2O ClOˉ+H2O![]() HClO+ OHˉ CO2 ClOˉ+ Clˉ+2H+=Cl2↑+H2O 排除因米醋被稀释导致颜色褪去的可能性 排除醋酸挥发产生刺激性气味气体的可能性 实验3最初阶段因溶液pH<2,主要发生反应ClOˉ+ Clˉ+2H+=Cl2↑+H2O;随着溶液pH>2,发生反应ClOˉ+CH3COOH=CH3COOˉ+HClO,使溶液褪色。实验4中最初阶段溶液pH较大,只发生ClOˉ+CH3COOH=CH3COOˉ+HClO,所以立即褪色 在中性条件下,次氯酸钠溶液中存在较多的次氯酸与OHˉ,有利于反应的进行,即次氯酸酯的形成和分解连续发生,此时纤维素很快被氧化,纤维强度受到严重损伤。(或:这是两个连续变化的过程,pH较小时,次氯酸浓度较高有利于第一阶段的反应,但OHˉ浓度较低不利于第二阶段的反应;pH较大时,OHˉ浓度较高有利于第二阶段的反应,但次氯酸浓度较低不利于第一阶段的反应。) 9~11 对棉布损伤小,且不会因pH过低产生氯气
HClO+ OHˉ CO2 ClOˉ+ Clˉ+2H+=Cl2↑+H2O 排除因米醋被稀释导致颜色褪去的可能性 排除醋酸挥发产生刺激性气味气体的可能性 实验3最初阶段因溶液pH<2,主要发生反应ClOˉ+ Clˉ+2H+=Cl2↑+H2O;随着溶液pH>2,发生反应ClOˉ+CH3COOH=CH3COOˉ+HClO,使溶液褪色。实验4中最初阶段溶液pH较大,只发生ClOˉ+CH3COOH=CH3COOˉ+HClO,所以立即褪色 在中性条件下,次氯酸钠溶液中存在较多的次氯酸与OHˉ,有利于反应的进行,即次氯酸酯的形成和分解连续发生,此时纤维素很快被氧化,纤维强度受到严重损伤。(或:这是两个连续变化的过程,pH较小时,次氯酸浓度较高有利于第一阶段的反应,但OHˉ浓度较低不利于第二阶段的反应;pH较大时,OHˉ浓度较高有利于第二阶段的反应,但次氯酸浓度较低不利于第一阶段的反应。) 9~11 对棉布损伤小,且不会因pH过低产生氯气
【解析】
(4)该同学的实验目的是为了探究84消毒液能否“漂白”米醋;因84消毒液中含有大量的水分,所以先设计实验1和2对比排除因米醋被稀释导致颜色褪去的可能性和醋酸挥发产生刺激性气味气体的可能性;之后设计了实验3和4进行米醋和84消毒液的互滴实验,向84消毒液中滴加米醋的时,由于次氯酸根的水解,溶液初始pH较大,而向米醋中滴加84时,由于醋酸的电离,溶液初始pH较小。
(1)84消毒液的有效成分为NaClO;电极c处发生2H2O+2e-=H2↑+2OHˉ,说明c处为电解池的阴极,则d处为阳极,氯离子放电产生氯气,且生成的氯气会浮上来与c处产生的氢氧根反应生成氯化钠和次氯酸钠,离子方程式为Cl2+2OHˉ=Clˉ+ClOˉ+H2O;
(2)次氯酸为弱酸,所以84消毒液中存在水解平衡ClOˉ+H2O![]() HClO+ OHˉ,加入少量NaOH溶液可以使其水解平衡逆向移动;而且NaOH还可以吸收空气中的二氧化碳防止消毒液失效;
HClO+ OHˉ,加入少量NaOH溶液可以使其水解平衡逆向移动;而且NaOH还可以吸收空气中的二氧化碳防止消毒液失效;
(3)pH降低时溶液中氢离子浓度增大,酸性环境下次氯酸根和氯离子发生归中反应生成氯气,离子方程式为ClOˉ+ Clˉ+2H+=Cl2↑+H2O;
(4)84消毒液中含有水,实验2作为对照可以排除因米醋被稀释导致颜色褪去的可能性;同时也可以排除醋酸挥发产生刺激性气味气体的可能性;
实验3最初阶段因溶液pH<2,主要发生反应ClOˉ+ Clˉ+2H+=Cl2↑+H2O;随着溶液pH>2,发生反应ClOˉ+CH3COOH=CH3COOˉ+HClO,使溶液褪色。实验4中最初阶段溶液pH较大,只发生ClOˉ+CH3COOH=CH3COOˉ+HClO,所以立即褪色;
(5)①在中性条件下,次氯酸钠溶液中存在较多的次氯酸与OHˉ,有利于反应的进行,即次氯酸酯的形成和分解连续发生,此时纤维素很快被氧化,纤维强度受到严重损伤。(或:这是两个连续变化的过程,pH较小时,次氯酸浓度较高有利于第一阶段的反应,但OHˉ浓度较低不利于第二阶段的反应;pH较大时,OHˉ浓度较高有利于第二阶段的反应,但次氯酸浓度较低不利于第一阶段的反应。)
(6)根据第3小题可知pH过低时会产生氯气,所以pH不能太低,据图可知pH为7到9时,对棉布损伤较大,pH为9~11时,对棉布损伤小,且不会因pH过低产生氯气。

【题目】硅是无机非金属材料的主角,硅芯片的使用,促进了信息技术的革命。
![]() 陶瓷、水泥和玻璃都属于传统硅酸盐材料。其中,生产普通玻璃的主要原料除了
陶瓷、水泥和玻璃都属于传统硅酸盐材料。其中,生产普通玻璃的主要原料除了![]() 、
、![]() 外还 ______,玻璃制作过程中发生了
外还 ______,玻璃制作过程中发生了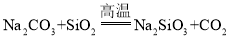 的反应,碳酸酸性强于硅酸,但为什么该反应可在高温下发生? ______。
的反应,碳酸酸性强于硅酸,但为什么该反应可在高温下发生? ______。
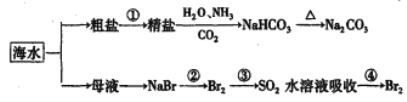
![]() 工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如图:
工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如图:
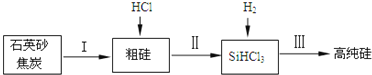
![]() 请写出反应Ⅱ、Ⅲ的化学方程式:Ⅱ ______、Ⅲ ______。
请写出反应Ⅱ、Ⅲ的化学方程式:Ⅱ ______、Ⅲ ______。
![]() 在流化床反应的产物中,
在流化床反应的产物中,![]() 大约占
大约占![]() ,所含有的其它物质的沸点数据如下表:
,所含有的其它物质的沸点数据如下表:
物质 | Si |
|
|
|
| HCl |
|
沸点 | 2355 |
|
|
|
|
|
|
提纯![]() 的主要工艺操作依次是沉降、冷凝和分馏
的主要工艺操作依次是沉降、冷凝和分馏![]() 相当于多次蒸馏
相当于多次蒸馏![]() 。沉降是为了除去 ______ ;在空气中冷凝所得液体主要含有 ______ ;若在实验室进行分馏提纯液体,应该采取以下加热方法中的 ______。
。沉降是为了除去 ______ ;在空气中冷凝所得液体主要含有 ______ ;若在实验室进行分馏提纯液体,应该采取以下加热方法中的 ______。
A.电炉加热![]() 酒精灯加热
酒精灯加热![]() 砂浴加热
砂浴加热![]() 水浴加热
水浴加热
![]() 极易水解,其完全水解时的反应方程式为 ______。
极易水解,其完全水解时的反应方程式为 ______。