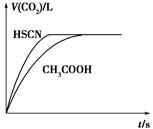
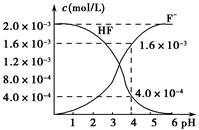
题目内容
中学化学实验中,淡黄色的pH试纸常用于测定溶液的酸碱性。在25 ℃时,若溶液的pH=7,试纸不变色;若pH<7,试纸变红色;若pH>7,试纸变蓝色。而要精确测定溶液的pH,需用pH计。pH计主要通过测定溶液中H+浓度来测定溶液的pH。
(1)已知水中存在平衡:H2O H++OH- ΔH>0,现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是 (填字母)。
H++OH- ΔH>0,现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是 (填字母)。
| A.向水中加入NaHSO4 |
| B.向水中加入Cu(NO3)2 |
| C.加热水至100 ℃[其中c(H+)=1×10-6 mol·L-1] |
| D.在水中加入(NH4)2SO4 |
(1)BD (2)淡黄 中 < 中
解析

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下表列出了某冷轧厂排放的废水中各成分的含量及国家环保标准值的有关数据:
| | 冷轧含锌 废水水质 | 经处理后的水国 家环保标准值 |
| Zn2+浓度/(mg·L-1) | ≤800 | ≤3.9 |
| pH | 1~5 | 6~9 |
| SO42-浓度/(mg·L-1) | ≤23 000 | ≤150 |
经某一工艺处理后的废水pH=8,常温下,该废水中Zn2+的浓度为 mg·
L-1(常温下,Ksp[Zn(OH)2]=1.2×10-17), (填“符合”或“不符合”)国家环保标准。
已知25°C时:
| 电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶度积 | 1.8×10-11 | 2.2×10-20 | 8.0×10-16 | 4.0×10-38 |
| 完全沉淀时的pH | 9.7 | 5.0 | 5.5 | 4.0 |
在物质的提纯中,常利用难溶电解质的沉淀溶解平衡原理除去某些离子。例如:
①为了除去氯化铵晶体中的氯化铁杂质,先将混合物溶于水,再加入一定量的试剂a进行反应,过滤结晶即可;
②为了除去氯化镁晶体中的氯化铁杂质,先将混合物溶于水,再加入足量的氢氧化镁充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的硫酸亚铁杂质,先将混合物溶于水,再加入一定量的双氧水,将亚铁离子氧化,然后加入试剂b调节溶液的pH=4,过滤结晶即可。
(1)上述三种除杂方案都将Fe2+、Fe3+转化为________(填化学式)而除去。
(2)试剂a为________。
(3)写出②中除杂所发生的总反应的离子方程式:________。
(4)下列与方案③有关的叙述正确的是________(填字母序号)。
A.H2O2是绿色氧化剂,在氧化过程中不引入杂质,不产生污染
B.将亚铁离子氧化的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4的试剂b是氢氧化铜或氧化铜
D.在pH大于4的溶液中Fe3+已完全不存在

 、H+、CO
、H+、CO 、H2O、________、________(填写微粒符号)。
、H2O、________、________(填写微粒符号)。 )从大到小的顺序为:____________(填序号)。
)从大到小的顺序为:____________(填序号)。