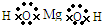题目内容
I 取一小段镁带,用砂纸除去表面的氧化膜,放入试管中.向试管中加入2mL水,并滴入2滴酚酞试液.一会儿后发现镁带表面有气泡放出,且镁带附近溶液变红色.加热试管至水沸腾.发现镁带表面有大量气泡放出,且试管中的液体全部变为浅红色.关于该试验,下列说法正确的是A.温度越高,镁与水反应的速率越快
B.镁与水反应的化学方程式为:Mg+2H2O═Mg(OH)2+H2↑
C.氢氧化镁显碱性,且在水中有一定的溶解性
D.氢氧化镁是离子化合物,它的电子式可表示为:
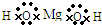
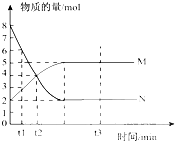
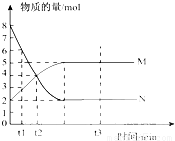
II 一定温度下,在容积为 VL的密闭容器中进行反应:aN(g)
 bM(g),M、N的物质的量随时间的变化曲线如右图所示:
bM(g),M、N的物质的量随时间的变化曲线如右图所示:(1)此反应的化学方程式中a/b=
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:
(3)下列叙述能说明上述反应达到平衡状态的是 (填序号)
A.反应中M与N的物质的量之比为1:1
B.混合气体的密度不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.正反应速率与逆反应速率均为零.
【答案】分析:Ⅰ镁是活泼金属,在加热条件下与水反应,反应的方程式为Mg+2H2O═Mg(OH)2+H2↑,反应后溶液呈碱性;
Ⅱ(1)根据物质的量之比等于化学计量数之比判断;
(2)根据v=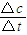 计算反应速率;
计算反应速率;
(3)达到平衡状态时,正逆反应速率相等,各物质的浓度、质量、含量等不发生变化,以及一些衍生的物理量不再发生变化,以此进行分析.
解答:解:ⅠA.温度升高,反应速率加快,故A正确;
B.镁是活泼金属,在加热条件下与水反应,反应的方程式为Mg+2H2O═Mg(OH)2+H2↑,故B正确;
C.滴加酚酞镁带附近溶液变红色,说明氢氧化镁显碱性,且在水中有一定的溶解性,故C正确;
D.氢氧化镁是离子化合物,电子式中应带电荷,故D错误.
故答案为:ABC;
Ⅱ(1)物质的量之比等于化学计量数之比,则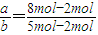 =2,故答案为:2;
=2,故答案为:2;
(2)v=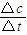 =
=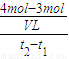 =
=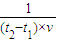 mol/(L?min ),故答案为:
mol/(L?min ),故答案为: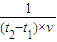 mol/(L?min );
mol/(L?min );
(3)A.反应是否达到平衡状态与反应的配比数无关,故A错误;
B.因反应容器的体积不变,气体的质量不变,则无论是否达到平衡状态,则混合气体的密度不随时间的变化而变化,故B错误;
C.混合气体的总物质的量不随时间的变化而变化,说明达到平衡状态,故C正确;
D.无论是否达到平衡状态,物质的物质的量之比都等于化学计量数之比,故D错误;
E.反应达到平衡状态时,混合气体的压强不随时间的变化而变化,故E正确;
F.化学平衡为动态平衡,平衡时正逆反应速率相等,但速率不为0,故F错误.
故答案为:CE.
点评:本题考查化学反应速率的影响因素、平衡状态的判断等问题,题目难度不大,注意基础知识的积累.
Ⅱ(1)根据物质的量之比等于化学计量数之比判断;
(2)根据v=
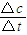 计算反应速率;
计算反应速率;(3)达到平衡状态时,正逆反应速率相等,各物质的浓度、质量、含量等不发生变化,以及一些衍生的物理量不再发生变化,以此进行分析.
解答:解:ⅠA.温度升高,反应速率加快,故A正确;
B.镁是活泼金属,在加热条件下与水反应,反应的方程式为Mg+2H2O═Mg(OH)2+H2↑,故B正确;
C.滴加酚酞镁带附近溶液变红色,说明氢氧化镁显碱性,且在水中有一定的溶解性,故C正确;
D.氢氧化镁是离子化合物,电子式中应带电荷,故D错误.
故答案为:ABC;
Ⅱ(1)物质的量之比等于化学计量数之比,则
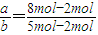 =2,故答案为:2;
=2,故答案为:2;(2)v=
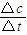 =
=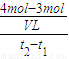 =
=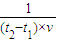 mol/(L?min ),故答案为:
mol/(L?min ),故答案为: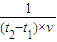 mol/(L?min );
mol/(L?min );(3)A.反应是否达到平衡状态与反应的配比数无关,故A错误;
B.因反应容器的体积不变,气体的质量不变,则无论是否达到平衡状态,则混合气体的密度不随时间的变化而变化,故B错误;
C.混合气体的总物质的量不随时间的变化而变化,说明达到平衡状态,故C正确;
D.无论是否达到平衡状态,物质的物质的量之比都等于化学计量数之比,故D错误;
E.反应达到平衡状态时,混合气体的压强不随时间的变化而变化,故E正确;
F.化学平衡为动态平衡,平衡时正逆反应速率相等,但速率不为0,故F错误.
故答案为:CE.
点评:本题考查化学反应速率的影响因素、平衡状态的判断等问题,题目难度不大,注意基础知识的积累.

练习册系列答案
相关题目
 I 取一小段镁带,用砂纸除去表面的氧化膜,放入试管中.向试管中加入2mL水,并滴入2滴酚酞试液.一会儿后发现镁带表面有气泡放出,且镁带附近溶液变红色.加热试管至水沸腾.发现镁带表面有大量气泡放出,且试管中的液体全部变为浅红色.关于该试验,下列说法正确的是
I 取一小段镁带,用砂纸除去表面的氧化膜,放入试管中.向试管中加入2mL水,并滴入2滴酚酞试液.一会儿后发现镁带表面有气泡放出,且镁带附近溶液变红色.加热试管至水沸腾.发现镁带表面有大量气泡放出,且试管中的液体全部变为浅红色.关于该试验,下列说法正确的是
 bM(g),M、N的物质的量随时间的变化曲线如右图所示:
bM(g),M、N的物质的量随时间的变化曲线如右图所示: