题目内容
由一种阳离子与两种酸根离子组成的盐称为混盐。根据你已有的知识,分析下列不属于混盐的是:
- A.Na4S2O3
- B.CaOCl2
- C.KAl(SO4)2
- D.Ca(NO3)Cl
C
试题分析:KAl(SO4)2是由两种阳离子与一种酸根离子组成的盐,属于复盐,强于选项都是混盐,答案选C。
考点:考查物质组成的有关判断
点评:该题是中等难度的试题,试题综合性强,侧重对学生答题能力的培养和训练,旨在考查学生灵活运用基础知识解决实际问题的能力。该题主要是考查学生对已知信息的提炼、归纳、总结和应用的能力,有利于培养学生的创新思维能力和应试能力。
试题分析:KAl(SO4)2是由两种阳离子与一种酸根离子组成的盐,属于复盐,强于选项都是混盐,答案选C。
考点:考查物质组成的有关判断
点评:该题是中等难度的试题,试题综合性强,侧重对学生答题能力的培养和训练,旨在考查学生灵活运用基础知识解决实际问题的能力。该题主要是考查学生对已知信息的提炼、归纳、总结和应用的能力,有利于培养学生的创新思维能力和应试能力。

练习册系列答案
相关题目
人们对酸碱的认识,已有几百年的历史,经历了一个由浅入深、由低级到高级的认识过程。我们目前中学课本中的酸碱理论是1887年阿仑尼乌斯(Arrhenius)提出了的电离理论。
(1)1905年富兰克林(Franklin)把阿仑尼乌斯以水为溶剂的个别现象,推到任何溶剂,提出了酸碱溶剂理论。溶剂理论认为:凡能离解而产生溶剂正离子的物质为酸,凡能离解而产生溶剂负离子的物质为碱。试写出五氯化磷在某条件下自身电离的方程式:
▲ (一种为正四面体阳离子,另一种为正八面体阴离子)。
(2)1923年丹麦化学家布朗斯物(Brφusted)和英国化学家劳莱(Lowry)提出了质子论。凡是能够释放质子(氢离子)的任何含氢原子的分子或离子都是酸;凡是能与质子(氢离子)结合的分子或离子都是碱。按质子理论:下列粒子在水溶液既可看作酸又可看作碱的是 ▲ 。
| A.HSO3- | B.NH4+ | C.OH- | D.HCO3- E.CH3COO- F.Cl- |
酸(电子对接受体) 碱(电子对给予体) 反应产物
H+ + [∶OH ]—
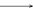 H∶OH
H∶OH试指出下列两个反应中的酸或碱
①H3BO3 + H2O = H+ + B(OH)4- 该反应中的碱是 ▲ (填:H3BO3或 H2O)
②BF3 + NH3 = BF3· NH3 该反应中的酸是 ▲ (填:BF3 或 NH3)
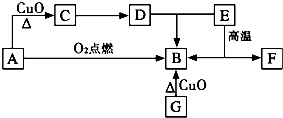 A是生活中最常见的有机物,该化合物的蒸气对氢气的相对密度是23,是生物燃料之一.C的溶液能发生银镜反应,反应后的溶液经酸化可得D.G为单质,其原子最外层电子数为次外层的2倍.F中阴阳离子个数比为1:1,其阳离子与Ar具有相同的电子层结构,A-F的转化关系如图.?
A是生活中最常见的有机物,该化合物的蒸气对氢气的相对密度是23,是生物燃料之一.C的溶液能发生银镜反应,反应后的溶液经酸化可得D.G为单质,其原子最外层电子数为次外层的2倍.F中阴阳离子个数比为1:1,其阳离子与Ar具有相同的电子层结构,A-F的转化关系如图.? H∶OH
H∶OH