题目内容
在一定条件下发生反应:2A(g)+2B(g)?xC(g)+2D(g),在2L密闭容器中,把4molA和2molB混合,2min后达到平衡时生成1.6molC,又测得反应速率VD=0.2mol/(L?min),下列说法正确的是( )
| A.A和B的转化率均是20% |
| B.x=4 |
| C.平衡时A的物质的量为2.8mol |
| D.平衡时气体压强比原来减小 |
VD=0.2mol/(L?min),VC=
=0.4mol/(L?min),由反应速率之比等于化学计量数之比,则x=4,
2A(g)+2B(g)?4C(g)+2D(g),
开始 4 2 0 0
转化0.8 0.8 1.6 0.8
平衡3.2 1.2 1.6 0.8
A.A的转化率为
×100%=20%,B的转化率为
×100%=40%,故A错误;
B.由上述分析可知,x=4,故B正确;
C.平衡时A的物质的量为3.2mol,故C错误;
D.平衡时气体的物质的量之和为3.2mol+1.2mol+1.6mol+0.8mol>4mol+2mol,则反应后压强增大,故D错误;
故选B.
| ||
| 2min |
2A(g)+2B(g)?4C(g)+2D(g),
开始 4 2 0 0
转化0.8 0.8 1.6 0.8
平衡3.2 1.2 1.6 0.8
A.A的转化率为
| 0.8mol |
| 4mol |
| 0.8mol |
| 2mol |
B.由上述分析可知,x=4,故B正确;
C.平衡时A的物质的量为3.2mol,故C错误;
D.平衡时气体的物质的量之和为3.2mol+1.2mol+1.6mol+0.8mol>4mol+2mol,则反应后压强增大,故D错误;
故选B.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
 如图是一些重要工业生产的转化关系(反应条件略去):
如图是一些重要工业生产的转化关系(反应条件略去):

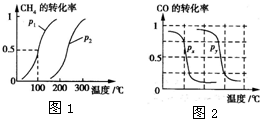 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应Ⅰ和Ⅱ来制备甲醇.请回答下列问题:
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应Ⅰ和Ⅱ来制备甲醇.请回答下列问题: