题目内容
16. 忍冬花又名金银花,其有效活性成分具有广泛的杀菌消炎功效,结构如图所示,下列有关该有机物的说法正确的是(已知有机物中一个碳原子同时连接4个不同基团时的碳原子为手性碳原子)( )
忍冬花又名金银花,其有效活性成分具有广泛的杀菌消炎功效,结构如图所示,下列有关该有机物的说法正确的是(已知有机物中一个碳原子同时连接4个不同基团时的碳原子为手性碳原子)( )| A. | 1个该分子中含有4个手性碳原子 | |
| B. | 分子式为C16H8O9 | |
| C. | 1mol该有机物最多与7molNaOH反应 | |
| D. | 该分子中有4种化学环境不同的氢原子 |
分析 含4个不同基团的C原子为手性碳原子,由结构可知分子式,分子中含-OH、酚-OH、-COOH、-COOC-及碳碳碳双键,以此来解答.
解答 解:A.与3个-醇OH及-COOC-相邻的环状结构上的C为手性碳原子,共4个,故A正确;
B.由结构可知分子式为C16H18O9,故B错误;
C.2个酚-OH、-COOH、-COOC-与NaOH反应,则1mol该有机物最多与4molNaOH反应,故C错误;
D.该分子中有14种氢原子,故D错误;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握结构中官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意手性碳原子的判断,题目难度不大.

练习册系列答案
相关题目
6.氢氧化锂是制取锂和锂的化合物的原料,用电解法制备氢氧化锂的工作原理如图所示:下列叙述不正确的是( )


| A. | b极附近溶液的pH增大 | |
| B. | a极发生的反应为2H2O-4e-=O2↑+4H+ | |
| C. | 该法制备LiOH还可得到硫酸和氢气等产品 | |
| D. | 当电路中通过1 mol电子时,可得到2 mol LiOH |
7.下列关于化学与生产、生活的分析不正确的是( )
| A. | 酸雨是碳氮硫的氧化物大量排放引起的 | |
| B. | “火树银花”焰火的实质是金属元素的焰色反应 | |
| C. | 侯氏制碱法所用氨水是利用了其碱性 | |
| D. | 工业上由石油获取乙烯过程中既有物理变化又有化学变化 |
4.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1molCl2与足量Fe反应转移电子数一定为3NA | |
| B. | 标准状况下,2.24LNH3中含有共价键的数目为NA | |
| C. | 标况下,11.2LSO3所含的分子数目为0.5NA | |
| D. | lmolNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
11.下列设计的实验方案能达到相应实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 蛋白质发生了变性 | 向蛋白质溶液中加入CuCl2或(NH4)2SO4饱和溶液 |
| B | 证明反应速率会随反应物浓度的增大而加快 | 用3mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然 后加入1mL 1mol•L-1CuSO4溶液,迅速产生较多气泡 |
| C | 比较Ksp(BaCO3)、Ksp(BaSO4) | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤, 向洗净的沉淀中加稀盐酸,有气泡产生 |
| D | 通过观察液面差判断该装置的气密性 | 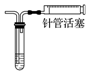 向里推注射器 向里推注射器 |
| A. | A | B. | B | C. | C | D. | D |
1.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 0.1 mol的白磷(P4)或甲烷中所含的共价键数均为0.4NA | |
| B. | 将1 mol Cl2通入水中,HC1O、Cl-、ClO-粒子数之和为2NA | |
| C. | 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2NA | |
| D. | 密闭容器中2 mol NO与1 mol O2充分反应后,产物的分子数为NA |
8.常温下,往某浓度的氯水中滴人Na2SO3溶液的pH变化如图所示,下列离子浓度的关系错误的是( )

| A. | a点:c(H+)>c(Cl-)>c(ClO-) | |
| B. | b点:$\frac{1}{2}$ c(Cl-)═c(SO42-)=0.005mol•L-1 | |
| C. | c点:c(Na+)═2c(HSO3-)+2c(SO32-) | |
| D. | d 点:c(Na+)═c(Cl-)+c(HSO3-)+2c(SO32-)+2c(SO42-) |
9.下列物质属于油脂的是( )
| A. | 汽油 | B. | 花生油 | C. | 煤油 | D. | 甘油 |
10.a、b、c、d是原子序数依次增大的四种主族元素,a的原子半径最小,b形成的一种单质在天然物质中硬度最大,d在地壳中含量最高.则下列叙述正确的是( )
| A. | a、c、d形成的所有化合物只含共价键 | |
| B. | a、b、c、d形成原子数目比为4:1:2:1的化合物只有一种 | |
| C. | a、c形成的化合物中可能含有非极性键 | |
| D. | a分别与b、c、d形成的二元化合物中d的沸点最高 |