题目内容
已知盐酸参加的下列三个反应:
① CaCO3+2HCl=CaCl2+CO2↑+H2O
② Fe+2HCl=FeCl2+H2↑
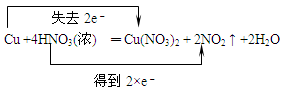
③ MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)判断上述三个反应中属于氧化还原反应的是_________,其中盐酸作还原剂的是__________。
(2)上述反应说明盐酸具有_______性,______性,_______性。
① CaCO3+2HCl=CaCl2+CO2↑+H2O
② Fe+2HCl=FeCl2+H2↑
③ MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O(1)判断上述三个反应中属于氧化还原反应的是_________,其中盐酸作还原剂的是__________。
(2)上述反应说明盐酸具有_______性,______性,_______性。
(1)②③ ,③ (2)酸 , 氧化 ,还原(各1分)
试题分析:(1)有电子转移的化学反应是氧化还原反应,失电子化合价升高的反应物是还原剂。①CaCO3+2HCl=CaCl2+CO2↑+H2O中,各元素化合价都不变,所以不是氧化还原反应,为复分解反应;②Fe+2HCl=FeCl2+H2↑中,铁失电子化合价升高,盐酸中氢元素得电子化合价降低,所以该反应是氧化还原反应,盐酸作氧化剂;③MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O中锰元素得电子化合价降低,氯元素失电子化合价升高,所以该反应是氧化还原反应,且盐酸是还原剂,故答案为:②③;③。
MnCl2+Cl2↑+2H2O中锰元素得电子化合价降低,氯元素失电子化合价升高,所以该反应是氧化还原反应,且盐酸是还原剂,故答案为:②③;③。(2)根据各反应酸中各元素化合价变化来确定其性质。通过(1)知,①中盐酸起酸作用,②中盐酸作氧化剂,③中盐酸作还原剂和酸性的作用,所以上述反应说明盐酸具有酸性、氧化性和还原性。

练习册系列答案
相关题目
 S
S



 2K2Cr2O7+4KOH+2H2↑+O2↑已知K2CrO4铬酸钾溶液中存在平衡:2CrO42-(黄色)+2H+
2K2Cr2O7+4KOH+2H2↑+O2↑已知K2CrO4铬酸钾溶液中存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O通电后阳极区溶液由 变为 。原因是 。
Cr2O72-(橙色)+H2O通电后阳极区溶液由 变为 。原因是 。