题目内容
【题目】下列实验不合理的是
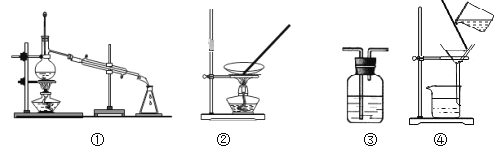
A. 用浓硫酸干燥SO2,选③
B. 从食盐溶液中获取NaCl,选②
C. 除去自来水中的Cl-,制纯净水,选④和①
D. 除去Fe(OH)3胶体中的难溶物,选④
【答案】C
【解析】
A.浓硫酸具有吸水性,与二氧化硫不反应;
B.NaCl为可溶性固体,与水分离选择蒸发;
C.自来水中水的沸点低,选择蒸馏法制备;
D.胶体能透过滤纸,难溶物不能。
A.浓硫酸具有吸水性,与二氧化硫不反应,则选③可干燥,所以A选项是合理的;
B.NaCl为可溶性固体,与水分离选择蒸发,则选②可得到NaCl,所以B选项是合理的;
C.自来水中水的沸点低,选择蒸馏法制备,则选①即可,故C选项不合理;
D.胶体能透过滤纸,难溶物不能,则选④过滤可除杂,所以D选项是合理的。
所以答案选C。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)滤渣1为_______________,操作A为_________________,向滤液②中加入双氧水的作用是___________________________________。
(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因_______________________________。
(4)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?_____________________________________________(列式计算)。FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。

