题目内容
【题目】书写下列微粒的电子式:
(1)NH4+:____________; CO2:__________;NaOH:________________ 。
(2)若2.6g乙炔(C2H2气态)完全燃烧生成液态水和CO2时放热130kJ。则此反应的热化学方程式为:________。
【答案】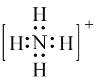
![]()
![]() C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l)ΔH=-1300kJ/mol
C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l)ΔH=-1300kJ/mol
【解析】
(1)氮原子最外层有5个电子,与3个氢原子各形成一个共用电子对,剩下1个孤对电子,与另一个H+,形成配位键,因而电子式可表示为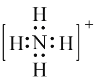 ;碳原子最外层有4个电子,与每个氧原子形成2对共用电子对,因而电子式为
;碳原子最外层有4个电子,与每个氧原子形成2对共用电子对,因而电子式为![]() ;NaOH为离子化合物,钠离子的电子式Na+,OH-的电子式为
;NaOH为离子化合物,钠离子的电子式Na+,OH-的电子式为![]() ,因而氢氧化钠的电子式为
,因而氢氧化钠的电子式为![]() 。
。
(2)2.6g乙炔为0.1mol,若2.6g乙炔(C2H2气态)完全燃烧生成液态水和CO2时放热130kJ,则1mol乙炔完全燃烧生成液态水和CO2时放热1300kJ,因而该燃烧热化学方程式为C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l)ΔH=-1300kJ/mol。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在生产生活中,酸碱中和及溶液酸碱性研究具有十分重要的意义。
(1)常温下,将2种一元酸分别和NaOH溶液等体积混合,实验数据如下:
组别 | c(一元酸) | c(NaOH) | 混合溶液的pH |
甲 | c(HY)=0.1mol/L | 0.1mol/L | pH=7 |
乙 | c(HZ)=0.1mol/L | 0.1mol/L | pH=9 |
①甲组实验中HY为_________(填强、弱)酸,0.1 moL/L HY溶液的pH=_____________。
②乙组实验中发生反应的离子方程式为_________________________________。
③乙组实验所得溶液中由水电离出的c(OH-)=________ mol/L。
(2)常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL0.1000mol/LHCl溶液和20.00mL 0.1000mol/LCH3COOH溶液,得到2条滴定曲线,如下图所示。

①滴定HCl溶液的曲线是___________(填“I”或“Ⅱ”);
②a=__________ mL。
③c(Na+)=c(CH3COO-)的点是_____________。
④E点对应离子浓度由大到小的顺序为_________________。
(3)将一定量某浓度的NaOH溶液,加入MgCO3悬浊液中,可以生成更难溶的Mg(OH)2。该反应的离子方程式为_____________________________。
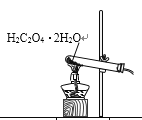
【题目】已知草酸晶体(H2C2O4·2H2O)的熔点为101℃,170℃分解。下列选用的装置和药品能达到实验目的的是
A | B | C | D |
|
|
|
|
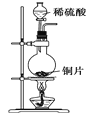
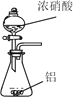
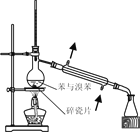
制取SO2 | 制取NO2 | H2C2O4·2H2O分解 | 分离苯与溴苯 |
A. A B. B C. C D. D