题目内容
(10分)欲用质量分数为98%、密度为1.84g/cm3的浓硫酸,配制0.2mol/L的硫酸溶液480mL。试回答下列问题:
(1)你所需要量取的浓硫酸的体积为 mL。
(2)除下图中仪器①②外,本实验还需要用到的玻璃仪器有:胶头滴管、 、 。
下图是某同学转移溶液的示意图,请改正图中的错误: 。

(3)配制过程中,造成浓度偏高的操作可能有 (填序号)。
E.定容时,俯视液面加水至刻度线
F.向容量瓶中转移浓溶液时不慎有液滴掉在容量瓶外面
G.将烧杯中溶解后的溶液立即转移入容量瓶,然后再加蒸馏水至刻度线
H.用胶头滴管向容量瓶中加水时,不慎超过刻度线,又用胶头滴管从容量瓶中吸出部分溶液,使液面的最低点刚好与刻度线相切
(1)你所需要量取的浓硫酸的体积为 mL。
(2)除下图中仪器①②外,本实验还需要用到的玻璃仪器有:胶头滴管、 、 。
下图是某同学转移溶液的示意图,请改正图中的错误: 。

(3)配制过程中,造成浓度偏高的操作可能有 (填序号)。
| A.容量瓶用蒸馏水洗后未干燥 |
| B.量筒用蒸馏水洗后未干燥 |
| C.未用水洗涤溶解过浓硫酸的烧杯 |
| D.用量筒量取浓硫酸时,俯视读数 |
F.向容量瓶中转移浓溶液时不慎有液滴掉在容量瓶外面
G.将烧杯中溶解后的溶液立即转移入容量瓶,然后再加蒸馏水至刻度线
H.用胶头滴管向容量瓶中加水时,不慎超过刻度线,又用胶头滴管从容量瓶中吸出部分溶液,使液面的最低点刚好与刻度线相切
(10分)(1)5.4 。(2分,多写单位无分)
(2)10mL量筒(1分,无规格无分)、玻璃棒(1分)。
应用玻璃棒引流;(1分) 应采用500mL容量瓶。(2分,错别字扣1分)
(3)EG (3分,填对1个得1分,全对得3分,错填无分。)
(2)10mL量筒(1分,无规格无分)、玻璃棒(1分)。
应用玻璃棒引流;(1分) 应采用500mL容量瓶。(2分,错别字扣1分)
(3)EG (3分,填对1个得1分,全对得3分,错填无分。)
(1)依据容量瓶的规格可知,需要配制500ml的溶液,可设需要浓硫酸的体积为V,则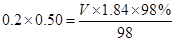 ,V=5.4ml
,V=5.4ml
(3)A:不影响;B:偏小;C:偏小;D:偏小;E:偏高;F:偏小;G:偏高;H:错误操作,偏小。
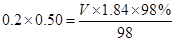 ,V=5.4ml
,V=5.4ml(3)A:不影响;B:偏小;C:偏小;D:偏小;E:偏高;F:偏小;G:偏高;H:错误操作,偏小。

练习册系列答案
 优等生题库系列答案
优等生题库系列答案
相关题目




 ]。然后分别做喷泉实验,三个烧瓶中所得溶液的物质的量浓度之比为( )
]。然后分别做喷泉实验,三个烧瓶中所得溶液的物质的量浓度之比为( )