题目内容
4.A~I分别表示中学化学中常见的一种物质,它们之间的相互关系如图所示(部分反应物、生成物没有列出),且已知G为地壳中含量最多的金属元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.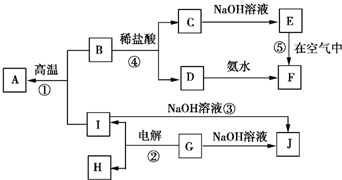
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素在周期表中的位置为第四周期第Ⅷ族.
(2)反应②阳极的电极反应式为2O2--4e-═O2↑,反应③的离子方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑,反应⑤的化学方程式为4Fe(OH)2+O2+2H2O═4Fe(OH)3.
(3)实验室配制C溶液时通常要加入少量的铁屑和稀盐酸;将少量D的浓溶液滴入沸水中得到的液体呈红褐色,再逐滴滴加盐酸时,产生的现象是先产生红褐色沉淀,后溶解得到黄色溶液;
(4)反应①中每生成3mol A,转移电子的物质的量为8mol.
分析 G为主族元素的固态氧化物,电解G得到I和H,G能和氢氧化钠溶液反应生成J,则G是Al2O3,I能和氢氧化钠溶液反应生成J,则I是Al,J是NaAlO2,H是O2,Al和B能在高温下反应生成A,铝在高温下能发生铝热反应,则B是金属氧化物,A是金属单质,B和盐酸反应生成C和D,C和氢氧化钠反应生成E,D和氨水反应生成F,E在空气中反应生成F,说明E不稳定,易被氧气氧化,且A、B、C、D、E、F六种物质中均含同一种元素,则A是Fe,B为Fe3O4,C为FeCl2,D为FeCl3,E为Fe(OH)2,F为Fe(OH)3,结合对应单质、化合物的性质解答该题.
解答 解:G为主族元素的固态氧化物,电解G得到I和H,G能和氢氧化钠溶液反应生成J,则G是Al2O3,I能和氢氧化钠溶液反应生成J,则I是Al,J是NaAlO2,H是O2,Al和B能在高温下反应生成A,铝在高温下能发生铝热反应,则B是金属氧化物,A是金属单质,B和盐酸反应生成C和D,C和氢氧化钠反应生成E,D和氨水反应生成F,E在空气中反应生成F,说明E不稳定,易被氧气氧化,且A、B、C、D、E、F六种物质中均含同一种元素,则A是Fe,B为Fe3O4,C为FeCl2,D为FeCl3,E为Fe(OH)2,F为Fe(OH)3,
(1)A、B、C、D、E、F六种物质中所含的同一种元素为Fe,位于周期表第四周期第Ⅷ族,故答案为:第四周期第Ⅷ族;
(2)电解熔融的氧化铝,阳极发生氧化反应生成氧气,电极方程式为2O2--4e-═O2↑,反应③为铝和氢氧化钠溶液的反应,生成偏铝酸钠和氢气,反应的离子方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑,反应⑤为氢氧化亚铁被氧化生成氢氧化铁的反应,方程式为4Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案为:2O2--4e-═O2↑;2Al+2OH-+2H2O═2AlO2-+3H2↑;4Fe(OH)2+O2+2H2O═4Fe(OH)3;
(3)氯化亚铁不稳定,易发生水解和氧化反应,为防止变质,在配制溶液时加入铁屑和稀盐酸,将少量氯化铁的浓溶液滴入沸水中发生水解生成氢氧化铁胶体,得到的液体呈红褐色,再逐滴滴加盐酸时,胶体聚沉,然后溶解生成氯化铁,产生的现象是先产生红褐色沉淀,后溶解得到黄色溶液,
故答案为:铁屑和稀盐酸;红褐;先产生红褐色沉淀,后溶解得到黄色溶液;
(4)反应①中每生成3mol Fe,需要1molFe3O4,转移电子的物质的量为8mol,故答案为:8 mol.
点评 本题考查无机物的推断,为高频考点,侧重于学生的分析、计算能力的考查,注意推断的关键点:①G为主族元素的固态氧化物,在电解条件下生成I和H,能与NaOH溶液反应,说明为Al2O3,②铝和B高温下发生反应,说明为铝热反应,再结合物质的其它性质分析解答,题目难度较大.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案| A. | 2Na+2NH3→2NaNH2+H2↑ | B. | 2NH3+3CuO→3Cu+N2+3H2O | ||
| C. | 4NH3+6NO→5N2+6H2O | D. | 3SiH4+4NH3→Si3N4+12H2 |
| A. | 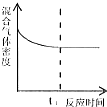 t1时刻表示该可逆反应达到新的平衡 | |
| B. | 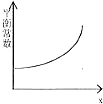 横坐标x可表示温度或容器的体积 | |
| C. | 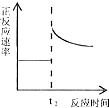 t2时刻改变的体积为加入少量的Y | |
| D. | 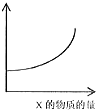 横坐标可表示为Z的体积分数 |
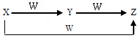 X、Y、Z、W有如图所示的转化关系,则X、Y可能是( )
X、Y、Z、W有如图所示的转化关系,则X、Y可能是( )①C、CO ②S、SO2 ③AlCl3、Al(OH)3 ④Cl2、FeCl3.
| A. | 仅有①③ | B. | ①②③ | C. | 仅有②④ | D. | ①②③④ |
 某充电宝锂离子电池的总反应为:xLi+Li1-nMn2O4$?_{充电}^{放电}$LiMn2O4,某手机镍氢电池总反应为:NiOOH+MH$?_{充电}^{放电}$M+Ni(OH)2(M为储氢金属或合金),有关上述 两种电池的说法不正确的是
某充电宝锂离子电池的总反应为:xLi+Li1-nMn2O4$?_{充电}^{放电}$LiMn2O4,某手机镍氢电池总反应为:NiOOH+MH$?_{充电}^{放电}$M+Ni(OH)2(M为储氢金属或合金),有关上述 两种电池的说法不正确的是( )
| A. | 锂离子电池放电时Li+向正极迁移 | |
| B. | 锂离子电池充电时,阴极的电极反应式:LiMn2O4-xe-=Li1-nMn2O4+xLi+ | |
| C. | 如图表示用锂离子电池给镍氢电池充电 | |
| D. | 镍氢电池放电时,正极的电极反应式:NiOOH+H2O+e-=Ni(OH)2+OH- |
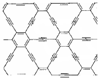 石墨炔是由1,3-二炔键与苯环形成的平面网状结构的全碳分子,具有优良的化学稳定性和半导体性能.下列关于石墨炔的说法不正确的是( )
石墨炔是由1,3-二炔键与苯环形成的平面网状结构的全碳分子,具有优良的化学稳定性和半导体性能.下列关于石墨炔的说法不正确的是( )| A. | 石墨炔属于芳香烃 | |
| B. | 石墨炔与金刚石互为同素异形体 | |
| C. | 石墨炔有望代替半导体材料硅在电子产品中得到广泛应用 | |
| D. | 石墨炔孔径略大于H2分子的直径,因此它是理想的H2提纯薄膜 |
| X | Y | |
| Z | W |
| A. | 最高正化合价:Z>X=W>Y | |
| B. | 原子半径:Y>X>W>Z | |
| C. | 最高价氧化物对应水化物的酸性:Z<X<W<Y | |
| D. | 最高价含氧酸的钠盐溶液能与SO2反应的:X、Y、Z、W |
| A. | 若乙为NaHCO3,则丙一定是CO2 | |
| B. | 若A为硝酸,X为金属元素,则甲与丙反应可生成乙 | |
| C. | 若A为NaOH溶液,X为短周期的金属元素,则乙一定为白色沉淀 | |
| D. | 若A为金属单质,乙的水溶液遇KSCN溶液变红,则甲可能为非金属单质 |
| A. | 乙烷 | B. | 乙醇 | C. | 乙酸 | D. | 二氧化硫 |